Concepto de 1 atmosfera como medida de presion en gases
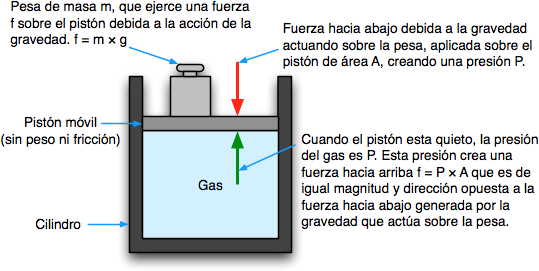
Cuando hablamos de gases, uno de los conceptos más importantes es la presión. La presión se refiere a la fuerza ejercida por un gas sobre las paredes del recipiente que lo contiene. Para medir la presión, se utiliza una unidad de medida llamada atmósfera (atm).
La atmósfera es una unidad de presión que se define como la presión ejercida por la atmósfera terrestre al nivel del mar. Es decir, cuando medimos la presión de un gas y decimos que es igual a 1 atm, estamos diciendo que la presión del gas es igual a la presión atmosférica al nivel del mar.
Pero, ¿por qué se utiliza la atmósfera como unidad de medida de la presión? La respuesta se remonta a la época en que se comenzó a estudiar la física de los gases. En el siglo XVII, el físico italiano Evangelista Torricelli demostró que la presión atmosférica podía ser medida utilizando un equipo llamado barómetro. Torricelli descubrió que la presión atmosférica al nivel del mar era suficiente para sostener una columna de mercurio de 760 milímetros de altura en un tubo cerrado al vacío.
A partir de entonces, se utilizó la presión atmosférica al nivel del mar como referencia para medir la presión de los gases. La unidad de medida que se utilizó para este fin fue la atmósfera, que se definió como la presión necesaria para sostener una columna de mercurio de 760 mm de altura en un barómetro.
Es importante destacar que la presión atmosférica varía con la altitud. A medida que nos alejamos del nivel del mar, la presión atmosférica disminuye. Por esta razón, cuando se mide la presión de un gas a una altitud diferente a la del nivel del mar, es necesario hacer una corrección para obtener la presión real en atmósferas.
En resumen, La atmósfera es una unidad de medida de la presión que se utiliza como referencia la presión atmosférica al nivel del mar. Esta unidad de medida fue establecida en el siglo XVII por el físico italiano Evangelista Torricelli, quien demostró que la presión atmosférica podía ser medida utilizando un barómetro. Aunque la presión atmosférica varía con la altitud, la atmósfera sigue siendo una unidad de medida muy útil en la física de los gases.
Comparación con otras unidades de medida de la presión
Además de la atmósfera, existen otras unidades de medida de la presión que se utilizan en diferentes campos de la ciencia y la tecnología. Algunas de las unidades más comunes son:
- Pascal (Pa): es la unidad básica del Sistema Internacional de Unidades (SI) para medir la presión. Un pascal es igual a una newton por metro cuadrado (N/m2).
- Bar (bar): es una unidad de presión que se utiliza en la industria y en la meteorología. Un bar es igual a 100.000 pascales.
- Torr (Torr): es una unidad de presión que se utiliza en la física y la química. Un torr es igual a la presión necesaria para sostener una columna de mercurio de 1 mm de altura en un barómetro.
- Libra por pulgada cuadrada (psi): es una unidad de presión que se utiliza en la industria y la tecnología. Una libra por pulgada cuadrada es igual a 6894,76 pascales.
A continuación, se presenta una tabla que muestra la equivalencia entre estas unidades de medida de la presión:
| Unidad de medida | Equivalencia |
|---|---|
| Atmósfera (atm) | 1 atm = 101325 Pa = 1,01325 bar = 760 Torr = 14,696 psi |
| Pascal (Pa) | 1 Pa = 0,00001 bar = 0,0075 Torr = 0,00015 psi |
| Bar (bar) | 1 bar = 100.000 Pa = 750,06 Torr = 14,5038 psi |
| Torr (Torr) | 1 Torr = 133,322 Pa = 0,00133 bar = 0,0193 psi |
| Libra por pulgada cuadrada (psi) | 1 psi = 6894,76 Pa = 0,06895 bar = 51,715 Torr |
Factores que afectan la presión de los gases
La presión de un gas depende de varios factores, entre los cuales se pueden mencionar:
- La temperatura: a medida que la temperatura de un gas aumenta, su presión también aumenta, siempre y cuando el volumen y la cantidad de gas se mantengan constantes. Este fenómeno se conoce como ley de Gay-Lussac.
- La cantidad de gas: a medida que se aumenta la cantidad de gas en un recipiente, su presión también aumenta, siempre y cuando la temperatura y el volumen se mantengan constantes. Este fenómeno se conoce como ley de Boyle-Mariotte.
- El volumen del recipiente: a medida que se disminuye el volumen de un recipiente que contiene un gas, su presión también aumenta, siempre y cuando la temperatura y la cantidad de gas se mantengan constantes. Este fenómeno se conoce como ley de Charles.
- La masa molecular del gas: la presión de un gas también depende de su masa molecular. En general, los gases más pesados ejercen una presión mayor que los gases más ligeros, siempre y cuando la temperatura, la cantidad de gas y el volumen se mantengan constantes.
Aplicaciones de la presión de los gases
La presión de los gases tiene muchas aplicaciones prácticas en la vida cotidiana y en diversos campos de la ciencia y la tecnología. Algunas de las aplicaciones más comunes son:
- En la industria alimentaria: la presión se utiliza en la conservación de alimentos enlatados y en la producción de bebidas gaseosas.
- En la medicina: la presión se utiliza en la administración de oxígeno y en la ventilación mecánica de pacientes con problemas respiratorios.
- En la aviación: la presión se utiliza en la cabina de los aviones para mantener una presión adecuada y evitar problemas de salud en los pasajeros y la tripulación.
- En la meteorología: la presión se utiliza en la elaboración de mapas y pronósticos del tiempo.
- En la industria química: la presión se utiliza en la síntesis de productos químicos y en la separación de mezclas.
Preguntas frecuentes
¿Qué es una atmósfera absoluta?
La atmósfera absoluta es una unidad de medida de la presión que se utiliza como referencia la presión cero, es decir, el vac

Deja una respuesta