Cual de las leyes de la termodinamica permite explicar el experimento
La termodinámica es una rama de la física que se encarga del estudio de las leyes que rigen la relación entre el calor, la energía y el trabajo. En esta área, se han establecido tres leyes fundamentales que permiten explicar los procesos físicos que ocurren en el universo. En este artículo, abordaremos cuál de las leyes de la termodinámica permite explicar un experimento específico.
El experimento en cuestión se trata de la expansión adiabática de un gas. En este caso, se toma un gas encerrado en un recipiente de volumen variable, y se deja que este se expanda de manera tal que no exista transferencia de calor con el ambiente. Es decir, el proceso es adiabático.
Para entender cuál de las leyes de la termodinámica permite explicar este fenómeno, primero debemos recordar cuáles son estas leyes:
Primera ley de la termodinámica
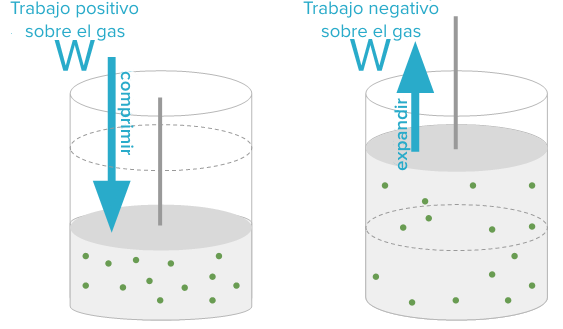
La primera ley de la termodinámica establece que la energía no se crea ni se destruye, sino que se transforma de una forma a otra. Es decir, la cantidad total de energía en un sistema aislado se mantiene constante. Esta ley se puede expresar mediante la siguiente fórmula:
ΔU = Q - W
Donde ΔU representa el cambio en la energía interna del sistema, Q es la cantidad de calor que se agrega al sistema y W es el trabajo realizado sobre el sistema.
Segunda ley de la termodinámica
La segunda ley de la termodinámica establece que el calor fluye de manera natural desde un cuerpo caliente a uno frío, y no al revés. Además, esta ley establece que la entropía de un sistema aislado siempre aumenta con el tiempo. En otras palabras, los procesos espontáneos siempre tienden a aumentar el desorden del sistema.
Tercera ley de la termodinámica
La tercera ley de la termodinámica establece que es imposible alcanzar el cero absoluto, es decir, una temperatura de -273,15°C. Esta ley se puede entender como una limitación física que impide que se alcance una temperatura absoluta.
Ahora, para entender cuál de las leyes de la termodinámica permite explicar el experimento de la expansión adiabática de un gas, debemos analizar las características del proceso. En este caso, se trata de una expansión en la que no existe transferencia de calor con el ambiente, lo que significa que el proceso es adiabático.
Debido a que no hay transferencia de calor, el cambio en la energía interna del sistema (ΔU) es igual a cero. Esto se debe a que la energía cinética de las partículas del gas se transforma en trabajo mecánico, lo que a su vez aumenta el volumen del recipiente en el que está contenido el gas.
Por lo tanto, la explicación de este experimento se basa en la primera ley de la termodinámica, que establece que la energía no se crea ni se destruye, sino que se transforma. En el caso de la expansión adiabática de un gas, la energía interna del sistema permanece constante, pero se transforma en trabajo mecánico.
En conclusión, La ley de la termodinámica que permite explicar el experimento de la expansión adiabática de un gas es la primera ley, ya que esta establece que la energía no se crea ni se destruye, sino que se transforma. En este caso, la energía interna del sistema permanece constante, pero se transforma en trabajo mecánico.
Preguntas frecuentes
¿Qué es la termodinámica?
La termodinámica es una rama de la física que se encarga del estudio de las leyes que rigen la relación entre el calor, la energía y el trabajo.
¿Cuáles son las leyes de la termodinámica?
Las leyes de la termodinámica son tres: la primera ley establece que la energía no se crea ni se destruye, sino que se transforma; la segunda ley establece que el calor fluye de manera natural desde un cuerpo caliente a uno frío y que la entropía de un sistema aislado siempre aumenta con el tiempo; y la tercera ley establece que es imposible alcanzar el cero absoluto.
¿Qué es un proceso adiabático?
Un proceso adiabático es aquel en el que no existe transferencia de calor con el ambiente. Es decir, no hay intercambio de calor entre el sistema y su entorno.
¿Qué es la energía interna de un sistema?
La energía interna de un sistema es la energía total que poseen todas las partículas que lo componen, incluyendo su energía cinética y potencial.
¿Qué es la entropía?
La entropía es una medida del desorden o la aleatoriedad de un sistema. La segunda ley de la termodinámica establece que la entropía de un sistema aislado siempre aumenta con el tiempo.

Deja una respuesta