Cual es el estado de oxidacion en la tabla periodica
La química es una ciencia fascinante que nos permite entender cómo se combinan los átomos para formar moléculas y compuestos. Uno de los conceptos más importantes en química es el estado de oxidación, que nos dice cuántos electrones ha perdido o ganado un átomo en una reacción química. En este artículo, vamos a explorar el estado de oxidación en la tabla periódica, y cómo podemos determinar cuál es el estado de oxidación de un átomo en un compuesto.
¿Qué es el estado de oxidación?
Antes de profundizar en el estado de oxidación en la tabla periódica, es importante entender qué es el estado de oxidación. En términos simples, el estado de oxidación de un átomo es su carga eléctrica neta, que resulta de la pérdida o ganancia de electrones. Cuando un átomo pierde electrones, su estado de oxidación es positivo, y cuando gana electrones, su estado de oxidación es negativo. Es importante tener en cuenta que el estado de oxidación no es lo mismo que la carga real de un átomo, sino que es una convención que nos ayuda a entender la reactividad química.
¿Cómo se determina el estado de oxidación?
El estado de oxidación de un átomo se puede determinar de varias maneras. En algunos casos, es fácil determinar el estado de oxidación simplemente al contar los electrones que ha perdido o ganado el átomo. Por ejemplo, el hidrógeno siempre tiene un estado de oxidación de +1 cuando se combina con otros elementos, ya que pierde un electrón para formar un catión. Del mismo modo, el oxígeno siempre tiene un estado de oxidación de -2 cuando forma compuestos, ya que tiende a ganar dos electrones.
En otros casos, determinar el estado de oxidación puede ser más complicado, especialmente cuando los elementos tienen diferentes estados de oxidación posibles. En estos casos, se utilizan reglas específicas para determinar el estado de oxidación. Por ejemplo, para elementos en el grupo 1 de la tabla periódica, el estado de oxidación es siempre +1, mientras que para elementos en el grupo 2, el estado de oxidación es siempre +2. Para elementos en el grupo 17, el estado de oxidación es siempre -1, y para elementos en el grupo 16, el estado de oxidación es generalmente -2, aunque también pueden tener estados de oxidación positivos.
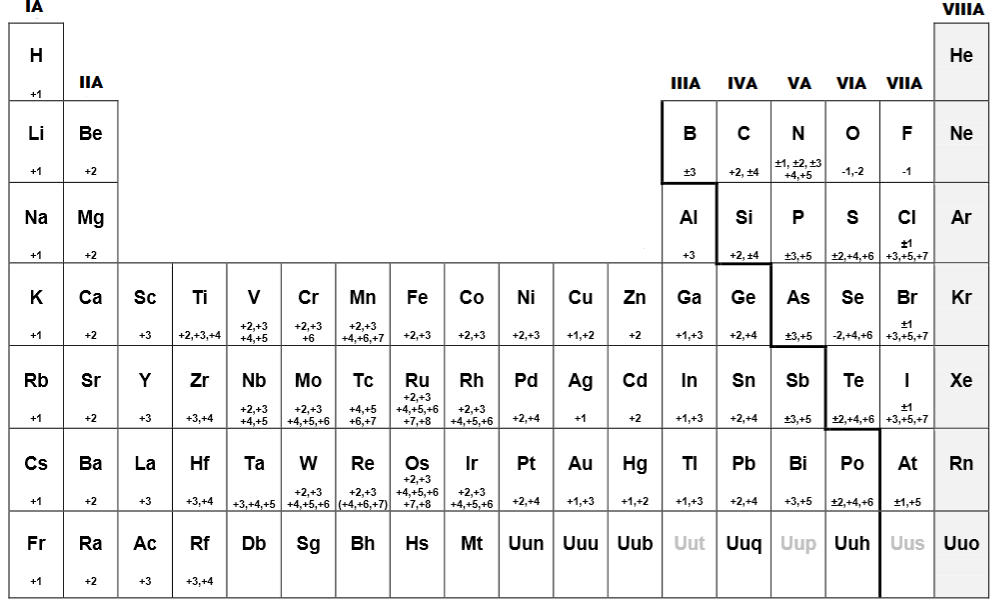
Estado de oxidación en la tabla periódica
La tabla periódica es una herramienta útil para entender el estado de oxidación de los elementos. En general, los elementos en la misma columna de la tabla periódica tienen estados de oxidación similares. Por ejemplo, los elementos en el grupo 1 siempre tienen un estado de oxidación de +1, mientras que los elementos en el grupo 17 siempre tienen un estado de oxidación de -1. Los elementos en el grupo 2 siempre tienen un estado de oxidación de +2, y los elementos en el grupo 16 generalmente tienen un estado de oxidación de -2.
Sin embargo, hay algunas excepciones a estas reglas generales. Por ejemplo, el hierro puede tener estados de oxidación positivos o negativos, dependiendo de las condiciones. En general, los metales tienden a tener estados de oxidación positivos, mientras que los no metales tienden a tener estados de oxidación negativos.
Comparación con tablas
Una forma útil de visualizar el estado de oxidación en la tabla periódica es mediante el uso de tablas. Las tablas son una forma de organizar información en una página web, y se pueden usar para mostrar información de manera clara y concisa. Al igual que la tabla periódica, las tablas tienen filas y columnas, y los elementos se organizan en función de sus propiedades.
En una tabla HTML que muestre el estado de oxidación de los elementos, cada elemento tendría su propio cuadro que mostraría su símbolo químico, su número atómico y su estado de oxidación más común. Los elementos en la misma columna tendrían estados de oxidación similares, y los elementos en la misma fila tendrían propiedades químicas similares.
Preguntas frecuentes
1. ¿Qué es el estado de oxidación?
El estado de oxidación de un átomo es su carga eléctrica neta, que resulta de la pérdida o ganancia de electrones.
2. ¿Cómo se determina el estado de oxidación?
El estado de oxidación de un átomo se puede determinar de varias maneras. En algunos casos, es fácil determinar el estado de oxidación simplemente al contar los electrones que ha perdido o ganado el átomo. En otros casos, se utilizan reglas específicas para determinar el estado de oxidación.
3. ¿Qué elementos tienen estados de oxidación similares?
En general, los elementos en la misma columna de la tabla periódica tienen estados de oxidación similares.
4. ¿Por qué es importante entender el estado de oxidación?
El estado de oxidación es importante porque nos ayuda a entender cómo se combinan los átomos para formar moléculas y compuestos, y cómo reaccionan estos compuestos en diferentes condiciones.
5. ¿Qué son las tablas?
Las tablas son una forma de organizar información en una página web, y se pueden usar para mostrar información de manera clara y concisa.

Deja una respuesta