El enlace covalente no polar se presenta cuando se unen
Cuando dos átomos se unen para compartir electrones, pueden formar diferentes tipos de enlaces químicos. Uno de estos tipos de enlace es el enlace covalente no polar. Este tipo de enlace se forma cuando los átomos comparten los electrones de manera igualitaria, lo que resulta en una molécula sin carga eléctrica neta.
Para entender mejor cómo funciona el enlace covalente no polar, es necesario conocer algunos conceptos básicos de química. En primer lugar, hay que recordar que los átomos tienen una estructura en capas electrónicas, cada una con un número máximo de electrones que puede contener. Los electrones de la capa más externa son los que participan en los enlaces químicos, ya sea compartiéndolos o transfiriéndolos.
Cuando dos átomos se unen para formar un enlace covalente, cada uno de ellos aporta uno o más electrones a la unión. En el caso del enlace covalente no polar, estos electrones se comparten de manera igualitaria, lo que significa que los átomos involucrados tienen la misma afinidad por los electrones. Esto se traduce en una molécula sin carga eléctrica neta, ya que los electrones están distribuidos de manera uniforme entre los átomos.
Un ejemplo común de enlace covalente no polar es el que se da en las moléculas de oxígeno y nitrógeno. En ambos casos, los átomos involucrados tienen una estructura electrónica similar, con una capa externa que puede contener hasta ocho electrones. Al unirse, comparten dos electrones para formar un enlace covalente no polar que les permite completar su capa externa con ocho electrones cada uno.
Es importante destacar que, aunque el enlace covalente no polar no produce una carga eléctrica neta, sí puede producir momentos dipolares en la molécula. Esto ocurre cuando la distribución de los electrones no es totalmente simétrica, lo que resulta en una pequeña diferencia de carga eléctrica entre las diferentes partes de la molécula. Aunque estos momentos dipolares son muy pequeños en comparación con los que se producen en los enlaces covalentes polares, pueden tener importantes implicaciones en la química de las moléculas.
En resumen, El enlace covalente no polar se presenta cuando dos átomos se unen y comparten electrones de manera igualitaria, produciendo una molécula sin carga eléctrica neta. Este tipo de enlace es común en moléculas de oxígeno y nitrógeno, entre otros, y puede producir momentos dipolares en la molécula. Aunque el enlace covalente no polar es menos común que el enlace covalente polar, es fundamental para entender la química de muchas moléculas y compuestos.
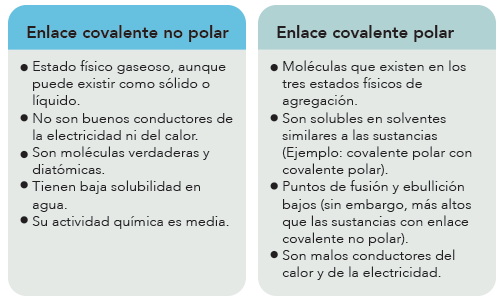
Tabla Comparativa
A continuación, se presenta una tabla comparativa entre el enlace covalente no polar y el enlace covalente polar:
| Enlace covalente no polar | Enlace covalente polar | |
|---|---|---|
| Definición | Enlace en el que los átomos comparten electrones de manera igualitaria, produciendo una molécula sin carga eléctrica neta. | Enlace en el que los átomos comparten electrones de manera desigual, produciendo una molécula con carga eléctrica neta. |
| Ejemplos | Moléculas de oxígeno, nitrógeno, hidrógeno. | Moléculas de agua, amoníaco, ácido clorhídrico. |
| Momentos dipolares | Pueden producir momentos dipolares en la molécula. | Producen momentos dipolares en la molécula. |
| Carga eléctrica neta | No tienen carga eléctrica neta. | Tienen carga eléctrica neta. |
Lista de Ejemplos de Enlaces Covalentes No Polares
- Molécula de oxígeno (O2)
- Molécula de nitrógeno (N2)
- Molécula de hidrógeno (H2)
- Molécula de dióxido de carbono (CO2)
- Molécula de metano (CH4)
- Molécula de etano (C2H6)
- Molécula de propano (C3H8)
- Molécula de butano (C4H10)
¿Cómo se representa un enlace covalente no polar?
El enlace covalente no polar se representa mediante una línea que une a los átomos que comparten electrones. En algunos casos, se puede dibujar una línea doble para enfatizar que se están compartiendo dos electrones. Además, se suele utilizar una letra griega delta (δ) para indicar que no hay una distribución de carga eléctrica significativa en la molécula.
¿Qué es un momento dipolar?
Un momento dipolar es una medida de la distribución de la carga eléctrica en una molécula. Se produce cuando hay una diferencia de electronegatividad entre los átomos que forman el enlace covalente y, por lo tanto, una distribución desigual de los electrones. Esto puede resultar en una pequeña carga eléctrica positiva en una parte de la molécula y una pequeña carga eléctrica negativa en otra parte. El momento dipolar se mide en unidades de debyes (D).
¿Cómo se diferencia el enlace covalente no polar del enlace covalente polar?
El enlace covalente no polar se diferencia del enlace covalente polar en que los electrones se comparten de manera igualitaria en el primero y de manera desigual en el segundo. En el enlace covalente polar, uno de los átomos tiene una mayor afinidad por los electrones y, por lo tanto, atrae más fuertemente los electrones compartidos, lo que resulta en una molécula con carga eléctrica neta. Además, los enlaces covalentes polares pueden producir momentos dipolares más grandes que los enlaces covalentes no polares.
¿Qué importancia tiene el enlace covalente no polar en la química?
El enlace covalente no polar es importante en la química porque se encuentra en muchas moléculas y compuestos que son fundamentales para la vida y la tecnología. Por ejemplo, el oxígeno y el nitrógeno son esenciales para la respiración y la fotosíntesis, mientras que el dióxido de carbono es un gas de efecto invernadero que contribuye al

Deja una respuesta