Espontaneidad termodinamica en una escala de potenciales de oxido reduccion
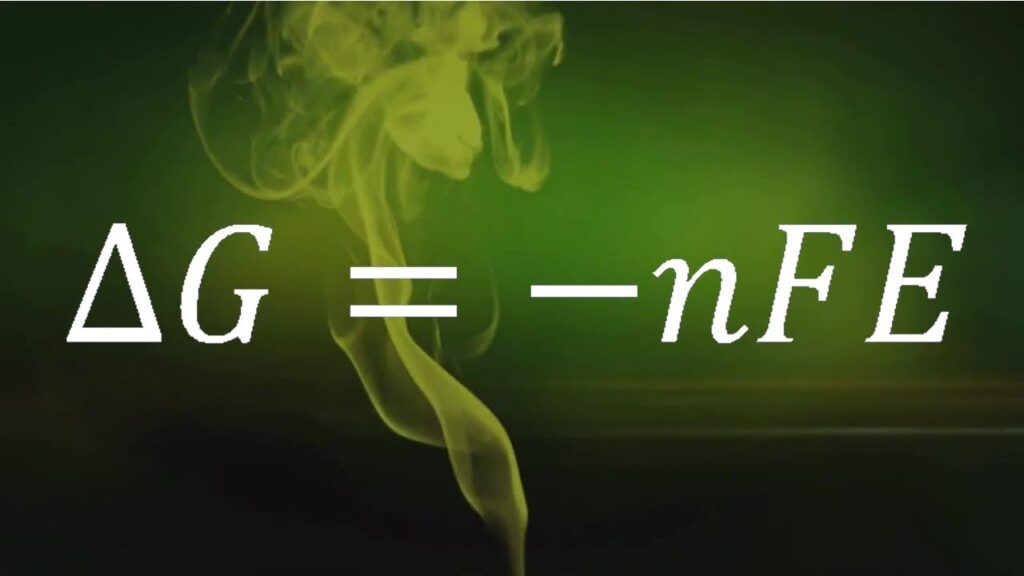
La espontaneidad termodinámica es un concepto clave en la química y la física que se refiere a la tendencia de un sistema a evolucionar hacia un estado de menor energía libre. En el contexto de la electroquímica y la oxidación-reducción, la espontaneidad se puede entender a través de la escala de potenciales de oxido-reducción, que mide la tendencia de una especie a ganar o perder electrones en una reacción redox.
En términos generales, una reacción redox es espontánea si la suma de los potenciales de oxidación y reducción de las especies involucradas es positiva. Esto significa que la reacción liberará energía y se llevará a cabo sin necesidad de una fuente externa de energía. Por el contrario, si la suma de los potenciales es negativa, la reacción no es espontánea y requerirá una fuente externa de energía para llevarse a cabo.
La escala de potenciales de oxido-reducción se basa en la comparación de la tendencia de dos especies a aceptar o donar electrones en una reacción redox. La especie con mayor tendencia a aceptar electrones se reduce y se convierte en un agente reductor, mientras que la especie con mayor tendencia a donar electrones se oxida y se convierte en un agente oxidante. La diferencia en los potenciales de oxidación y reducción de las especies se utiliza para calcular el potencial de la celda, que puede ser positivo, negativo o cero.
En la práctica, la escala de potenciales de oxido-reducción es una herramienta útil para predecir la espontaneidad de las reacciones redox y para diseñar celdas electroquímicas. Por ejemplo, si queremos diseñar una celda que produzca energía eléctrica a partir de una reacción redox espontánea, podemos seleccionar especies con potenciales de oxidación y reducción adecuados y diseñar una celda que maximice la transferencia de electrones entre ellas. Por otro lado, si queremos llevar a cabo una reacción redox no espontánea, podemos aplicar un potencial externo a la celda para impulsar la reacción en la dirección deseada.
En resumen, La espontaneidad termodinámica en una escala de potenciales de oxido-reducción es un concepto fundamental en la electroquímica y la oxidación-reducción. Permite predecir la dirección y la espontaneidad de las reacciones redox y diseñar celdas electroquímicas para producir energía eléctrica. La escala de potenciales de oxido-reducción es una herramienta valiosa para la química y la ingeniería, y su comprensión es esencial para cualquier persona interesada en la electroquímica y la energía.
Comparación con tablas
Al igual que una tabla HTML, la escala de potenciales de oxido-reducción organiza información en filas y columnas para facilitar su comprensión y uso. En una tabla HTML, cada celda contiene un valor o un conjunto de valores que se pueden manipular y comparar entre sí. De manera similar, en la escala de potenciales de oxido-reducción, cada especie tiene un conjunto de valores de potencial de oxidación y reducción que se pueden comparar para determinar la tendencia de la especie a aceptar o donar electrones.
Sin embargo, hay algunas diferencias importantes entre una tabla HTML y la escala de potenciales de oxido-reducción. En una tabla HTML, los valores de las celdas son fijos y no cambian, a menos que se actualicen manualmente o mediante una función automatizada. En la escala de potenciales de oxido-reducción, los valores de los potenciales de oxidación y reducción pueden cambiar dependiendo de las condiciones de la reacción redox, como la concentración de las especies y la temperatura.
Además, mientras que una tabla HTML puede tener un número limitado de filas y columnas, la escala de potenciales de oxido-reducción puede ser infinitamente grande, ya que hay muchas especies diferentes con diferentes potenciales de oxidación y reducción. Por lo tanto, la escala de potenciales de oxido-reducción es una herramienta más flexible y dinámica que permite la comparación de una amplia gama de especies y condiciones.
Preguntas frecuentes
¿Qué es la espontaneidad termodinámica?
La espontaneidad termodinámica es la tendencia de un sistema a evolucionar hacia un estado de menor energía libre. En el contexto de la electroquímica y la oxidación-reducción, la espontaneidad se puede entender a través de la escala de potenciales de oxido-reducción, que mide la tendencia de una especie a ganar o perder electrones en una reacción redox.
¿Qué es la escala de potenciales de oxido-reducción?
La escala de potenciales de oxido-reducción es una herramienta que se utiliza para medir la tendencia de una especie a aceptar o donar electrones en una reacción redox. La diferencia en los potenciales de oxidación y reducción de las especies se utiliza para calcular el potencial de la celda, que puede ser positivo, negativo o cero.
¿Cómo se utiliza la escala de potenciales de oxido-reducción?
La escala de potenciales de oxido-reducción se utiliza para predecir la espontaneidad de las reacciones redox y para diseñar celdas electroquímicas. También se puede utilizar para determinar el estado de oxidación o reducción de una especie en una reacción redox.
¿Qué es una especie oxidante y una especie reductora?
Una especie oxidante es aquella que tiene una alta tendencia a aceptar electrones y, por lo tanto, es capaz de oxidar otras especies. Una especie reductora es aquella que tiene una alta tendencia a donar electrones y, por lo tanto, es capaz de reducir otras especies.
¿Cómo se puede aplicar la escala de potenciales de oxido-reducción en la vida cotidiana?
La escala de potenciales de oxido-reducción se utiliza en muchos campos, como la química, la ingeniería y la biología. En la vida cotidiana, se puede aplicar en la producción de energía eléctrica a partir de celdas electroquímicas, como las utilizadas en las baterías de los teléfonos móviles y los coches eléctricos. También se utiliza en la purificación de agua y en la fabricación de productos químicos y materiales.

Deja una respuesta