Forma de kelvin - planck de la segunda ley de la termodinamica
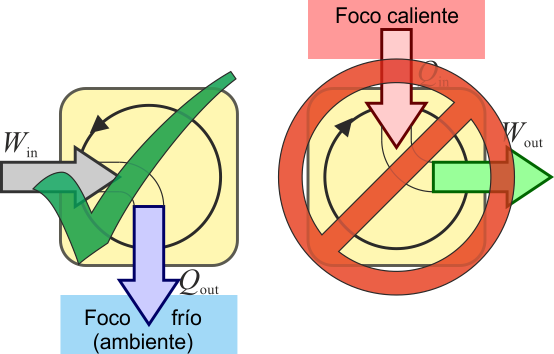
La termodinámica es una rama de la física que se encarga del estudio de las transformaciones energéticas que se producen en los sistemas físicos. La segunda ley de la termodinámica es una de las leyes fundamentales que rigen el comportamiento de los sistemas termodinámicos. Esta ley establece que en cualquier proceso termodinámico, la entropía de un sistema aislado no puede disminuir. Esto significa que la energía siempre tiende a dispersarse y que el calor no fluye de forma espontánea de un cuerpo frío a uno caliente.
La forma de Kelvin-Planck de la segunda ley de la termodinámica establece que es imposible construir una máquina térmica que, operando en un ciclo, produzca trabajo sin recibir calor de una fuente a mayor temperatura y cediéndolo a una fuente a menor temperatura. En otras palabras, no es posible construir una máquina que convierta completamente el calor en trabajo. Siempre habrá una cantidad de calor que se pierda.
La explicación de esta forma de la segunda ley de la termodinámica se basa en el concepto de eficiencia de una máquina térmica. La eficiencia de una máquina térmica se define como la relación entre el trabajo producido y el calor absorbido en un ciclo. La segunda ley de la termodinámica establece que la eficiencia de una máquina térmica que opera en un ciclo irreversible es siempre menor que la eficiencia de una máquina térmica que opera en un ciclo reversible entre las mismas temperaturas.
Un ciclo reversible es aquel en el que el sistema físico vuelve a su estado inicial después de una serie de transformaciones, sin que haya habido una pérdida neta de energía en forma de calor o trabajo. En cambio, un ciclo irreversible es aquel en el que hay una pérdida neta de energía en forma de calor o trabajo.
Para entender mejor esta forma de la segunda ley de la termodinámica, se puede hacer una analogía con una mesa de billar. En una mesa de billar, las bolas se mueven de forma caótica después de que se ha producido la colisión entre ellas. Aunque es posible que las bolas se muevan de forma ordenada, es imposible que vuelvan a su estado inicial sin que haya habido una pérdida de energía en forma de fricción con la mesa. De la misma forma, en un ciclo termodinámico irreversible, siempre habrá una pérdida neta de energía en forma de calor o trabajo.
En resumen, La forma de Kelvin-Planck de la segunda ley de la termodinámica establece que es imposible construir una máquina térmica que, operando en un ciclo, produzca trabajo sin recibir calor de una fuente a mayor temperatura y cediéndolo a una fuente a menor temperatura. Esto se debe a que siempre habrá una pérdida neta de energía en forma de calor o trabajo.
- Tabla comparativa de la eficiencia de una máquina térmica
- ¿Por qué es importante la segunda ley de la termodinámica?
- ¿Cuál es la relación entre la segunda ley de la termodinámica y la entropía?
- ¿Qué es una máquina térmica?
- ¿Qué es un ciclo termodinámico reversible?
- ¿Qué es un ciclo termodinámico irreversible?
Tabla comparativa de la eficiencia de una máquina térmica
Para entender mejor la eficiencia de una máquina térmica, se puede hacer una comparación entre la eficiencia de una máquina térmica que opera en un ciclo reversible y la eficiencia de una máquina térmica que opera en un ciclo irreversible. La siguiente tabla muestra la comparación:
| Ciclo termodinámico | Calor absorbido | Trabajo producido | Calor cedido | Eficiencia |
|---|---|---|---|---|
| Ciclo reversible | Q1 | W | Q2 | 1 - Q2/Q1 |
| Ciclo irreversible | Q1 | W | Q2 | W/Q1 |
Como se puede observar, la eficiencia de una máquina térmica que opera en un ciclo irreversible siempre es menor que la eficiencia de una máquina térmica que opera en un ciclo reversible entre las mismas temperaturas.
¿Por qué es importante la segunda ley de la termodinámica?
La segunda ley de la termodinámica es importante porque establece una limitación fundamental en la transformación de la energía. Esta ley establece que siempre habrá una pérdida neta de energía en forma de calor o trabajo en cualquier proceso termodinámico. Esto significa que no es posible construir una máquina que convierta completamente el calor en trabajo.
Además, la segunda ley de la termodinámica es importante porque tiene aplicaciones prácticas en la industria y en la vida cotidiana. Por ejemplo, esta ley se utiliza en la fabricación de motores de combustión interna, en la producción de energía eléctrica y en la refrigeración de alimentos y medicamentos.
¿Cuál es la relación entre la segunda ley de la termodinámica y la entropía?
La segunda ley de la termodinámica establece que la entropía de un sistema aislado no puede disminuir en cualquier proceso termodinámico. Esto significa que la energía siempre tiende a dispersarse y que el calor no fluye de forma espontánea de un cuerpo frío a uno caliente.
Por lo tanto, la entropía es una medida de la dispersión de la energía en un sistema termodinámico. La segunda ley de la termodinámica establece que la entropía siempre tiende a aumentar en cualquier proceso termodinámico. Esto significa que la energía siempre tiende a dispersarse y que el calor no fluye de forma espontánea de un cuerpo frío a uno caliente.
¿Qué es una máquina térmica?
Una máquina térmica es un dispositivo que convierte el calor en trabajo. Las máquinas térmicas utilizan un fluido de trabajo, como el vapor de agua o el aire, para realizar un ciclo termodinámico que produce trabajo. Las máquinas térmicas se utilizan en la industria para producir energía eléctrica, en la refrigeración de alimentos y medicamentos y en la fabricación de motores de combustión interna.
¿Qué es un ciclo termodinámico reversible?
Un ciclo termodinámico reversible es aquel en el que el sistema físico vuelve a su estado inicial después de una serie de transformaciones, sin que haya habido una pérdida neta de energía en forma de calor o trabajo. En un ciclo termodinámico reversible, el sistema físico se mueve de forma cuasiestática, es decir, se mueve muy lentamente, de tal forma que el sistema siempre esté en equilibrio termodinámico con su entorno.
¿Qué es un ciclo termodinámico irreversible?
Un ciclo termodinámico irreversible es aquel en el que hay una pérdida neta de energía en forma de calor o trabajo. En un ciclo termodinámico irreversible, el sistema físico se mueve de forma no-cuasiestática, es decir, se mueve de forma rápida o brus

Deja una respuesta