Leyes 0 i ii y iii de la termodinamica
Cuando hablamos de termodinámica, nos referimos al estudio de las transformaciones de la energía térmica. Esta rama de la física se divide en varias leyes que nos permiten entender cómo se comportan los sistemas termodinámicos. En este artículo, nos centraremos en las leyes 0, I, II y III de la termodinámica.
Ley 0 de la termodinámica
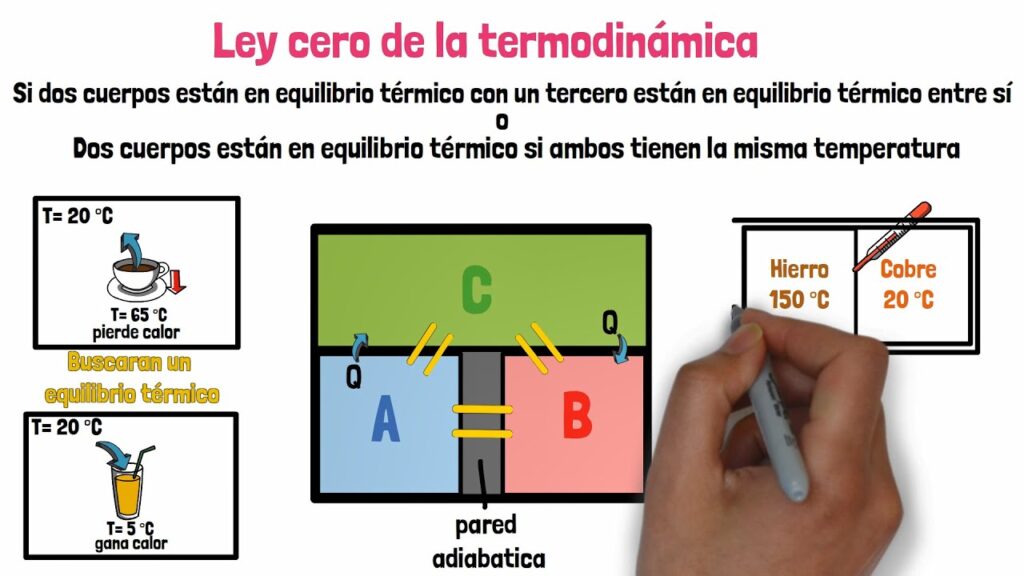
La ley cero de la termodinámica establece que cuando dos sistemas termodinámicos están en equilibrio térmico con un tercero, entonces están en equilibrio térmico entre sí. En otras palabras, si tenemos tres objetos A, B y C, y A está en equilibrio térmico con B, y B está en equilibrio térmico con C, entonces A y C también estarán en equilibrio térmico.
Esta ley es importante porque nos permite definir la temperatura de manera objetiva. Si dos objetos están en equilibrio térmico, entonces tienen la misma temperatura. Esto significa que podemos medir la temperatura de un objeto simplemente colocándolo en contacto con un termómetro en equilibrio térmico.
Ley I de la termodinámica
La primera ley de la termodinámica, también conocida como la ley de la conservación de la energía, establece que la energía no se crea ni se destruye, solo se transforma. En términos termodinámicos, esto significa que la energía interna de un sistema termodinámico es igual a la diferencia entre el calor agregado al sistema y el trabajo realizado por el sistema.
En otras palabras, si agregamos calor a un sistema, su energía interna aumentará. Si el sistema realiza trabajo, su energía interna disminuirá. Esta ley es fundamental para entender cómo se comportan los sistemas termodinámicos y cómo se puede aprovechar su energía.
Ley II de la termodinámica
La segunda ley de la termodinámica establece que el calor no puede fluir espontáneamente de un objeto frío a uno caliente. En otras palabras, el calor siempre fluye de un objeto caliente a uno frío. Esto se debe a que el calor siempre fluye de una región de alta energía a una de baja energía.
Esta ley también establece que la entropía de un sistema aislado siempre aumenta. La entropía es una medida de la cantidad de energía que no se puede convertir en trabajo. La segunda ley de la termodinámica nos dice que la entropía aumenta con el tiempo, lo que significa que la cantidad de energía que se puede convertir en trabajo disminuye con el tiempo.
Ley III de la termodinámica
La tercera ley de la termodinámica establece que es imposible alcanzar la temperatura de cero absoluto mediante un número finito de procesos termodinámicos. El cero absoluto es la temperatura más baja posible, a la cual todas las moléculas estarían en reposo absoluto.
Esta ley también establece que la entropía de un cristal perfecto en su estado más estable es cero a la temperatura de cero absoluto. En otras palabras, si un cristal perfecto se enfría a cero absoluto, su entropía será cero.
Comparación con tablas
Podemos comparar las leyes de la termodinámica con las tablas. Al igual que las tablas nos permiten organizar la información en filas y columnas, las leyes de la termodinámica nos permiten organizar el conocimiento sobre la energía térmica en principios claros y organizados.
Al igual que las tablas tienen diferentes tipos de etiquetas para organizar y dar formato a la información, las leyes de la termodinámica tienen diferentes principios que nos permiten entender cómo se comportan los sistemas termodinámicos en diferentes condiciones.
listas
Al igual que las listas nos permiten presentar la información en viñetas y puntos, podemos usar listas para resumir las leyes de la termodinámica:
- Ley 0: Dos sistemas termodinámicos en equilibrio térmico con un tercero están en equilibrio térmico entre sí.
- Ley I: La energía no se crea ni se destruye, solo se transforma.
- Ley II: El calor no puede fluir espontáneamente de un objeto frío a uno caliente.
- Ley III: Es imposible alcanzar la temperatura de cero absoluto mediante un número finito de procesos termodinámicos.
Conclusión
Las leyes de la termodinámica son fundamentales para entender el comportamiento de los sistemas termodinámicos y cómo podemos aprovechar su energía. La ley cero nos permite definir la temperatura objetivamente, mientras que la ley de la conservación de la energía nos dice que la energía no se crea ni se destruye, solo se transforma.
La segunda ley de la termodinámica nos dice que el calor siempre fluye de un objeto caliente a uno frío, mientras que la tercera ley establece que es imposible alcanzar la temperatura de cero absoluto mediante un número finito de procesos termodinámicos.
Preguntas frecuentes
1. ¿Por qué es importante la ley cero de la termodinámica?
La ley cero de la termodinámica nos permite definir la temperatura objetivamente y medirla con precisión.
2. ¿Qué significa la ley de la conservación de la energía?
La ley de la conservación de la energía establece que la energía no se crea ni se destruye, solo se transforma.
3. ¿Por qué el calor siempre fluye de un objeto caliente a uno frío?
El calor siempre fluye de una región de alta energía a una de baja energía, por lo que siempre fluye de un objeto caliente a uno frío.
4. ¿Qué es la entropía?
La entropía es una medida de la cantidad de energía que no se puede convertir en trabajo.
5. ¿Qué establece la tercera ley de la termodinámica?
La tercera ley de la termodinámica establece que es imposible alcanzar la temperatura de cero absoluto mediante un número finito de procesos termodinámicos.

Deja una respuesta