Modelacion del atomo para entender las propiedades de la materia
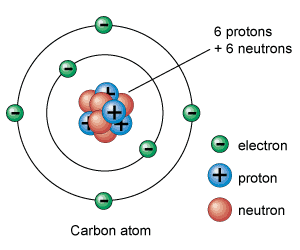
El átomo es la unidad básica de la materia, y su estudio es fundamental para entender las propiedades de los elementos que forman nuestro mundo. Desde la antigua Grecia, los filósofos han intentado explicar la naturaleza del átomo, pero fue a finales del siglo XIX cuando los científicos comenzaron a desarrollar modelos más precisos de esta estructura fundamental.
En este artículo, exploraremos la modelación del átomo y cómo ha evolucionado con el tiempo para ayudarnos a entender mejor las propiedades de la materia. Discutiremos las diferentes teorías que se han desarrollado a lo largo de la historia, desde la teoría atómica de Dalton hasta el modelo de nube electrónica de Schrödinger.
Teoría atómica de Dalton
La teoría atómica de Dalton, propuesta en el siglo XIX, estableció que el átomo era la unidad básica de la materia y que estaba compuesto por partículas subatómicas llamadas protones, neutrones y electrones. Dalton también sugirió que los átomos de diferentes elementos tenían diferentes pesos atómicos y que los compuestos se formaban cuando los átomos se combinaban en proporciones específicas.
Este modelo fue revolucionario en su tiempo y ayudó a establecer las bases de la química moderna. Sin embargo, con el tiempo, los científicos descubrieron que el modelo de Dalton era demasiado simplista y no explicaba todas las propiedades de la materia.
Modelo del átomo de Thomson
En 1897, JJ Thomson descubrió el electrón, una partícula subatómica con una carga negativa. Utilizando experimentos con rayos catódicos, Thomson propuso un nuevo modelo del átomo en el que los electrones se distribuían uniformemente en una esfera de carga positiva.
Este modelo, conocido como el modelo del átomo de Thomson, fue una mejora sobre el modelo de Dalton, pero aún no explicaba completamente las propiedades de la materia. En particular, no explicaba cómo los átomos de diferentes elementos tenían diferentes pesos atómicos.
Modelo del átomo de Rutherford
En 1911, Ernest Rutherford realizó un experimento en el que disparó partículas alfa contra una lámina de oro. Descubrió que la mayoría de las partículas pasaban a través de la lámina sin ser desviadas, pero algunas eran desviadas en ángulos agudos. Rutherford propuso un nuevo modelo del átomo en el que la carga positiva estaba concentrada en un pequeño núcleo en el centro del átomo y los electrones giraban alrededor del núcleo.
Este modelo, conocido como el modelo del átomo de Rutherford, explicaba cómo los átomos de diferentes elementos tenían diferentes pesos atómicos, pero también tenía limitaciones. No podía explicar la estructura de los átomos más complejos con más de un electrón y no podía explicar por qué los electrones no caían en el núcleo debido a la atracción electrostática.
Modelo del átomo de Bohr
En 1913, Niels Bohr propuso un nuevo modelo del átomo que combinaba las ideas de los modelos de Thomson y Rutherford. En el modelo de Bohr, los electrones se distribuían en órbitas alrededor del núcleo, y cada órbita tenía una energía específica. Los electrones podían saltar de una órbita a otra emitiendo o absorbiendo energía en forma de fotones.
El modelo de Bohr explicaba muchas de las propiedades de la materia, como la emisión de luz por los átomos cuando son excitados, pero aún tenía limitaciones. No podía explicar la estructura de los átomos más complejos con más de un electrón y no podía explicar las propiedades magnéticas de los átomos.
Modelo de nube electrónica
En la década de 1920, los científicos comenzaron a desarrollar una nueva teoría, conocida como la mecánica cuántica, que describía cómo funcionaban las partículas subatómicas en términos de ondas. Esta teoría llevó al desarrollo del modelo de nube electrónica, propuesto por Erwin Schrödinger en 1926.
En el modelo de nube electrónica, los electrones no se distribuyen en órbitas definidas, sino que se encuentran en una "nube" de probabilidad alrededor del núcleo. La forma de esta nube depende de la energía del electrón y puede cambiar cuando el electrón absorbe o emite energía.
Este modelo ha sido muy exitoso en explicar las propiedades de la materia y se utiliza ampliamente en la química y la física moderna. También ha llevado al desarrollo de modelos más avanzados, como el modelo de orbitales moleculares, que describe cómo los átomos se combinan para formar moléculas.
Conclusión
La modelación del átomo ha evolucionado significativamente a lo largo de la historia, desde la teoría atómica de Dalton hasta el modelo de nube electrónica de Schrödinger. Cada modelo ha mejorado nuestra comprensión de las propiedades de la materia, pero también ha tenido limitaciones que han sido superadas por modelos más avanzados.
El modelo de nube electrónica es el modelo más avanzado y exitoso que tenemos en la actualidad para entender las propiedades de la materia. Su uso ha llevado a increíbles avances en la química y la física moderna y seguirá siendo un pilar fundamental de la ciencia en el futuro.
Preguntas frecuentes
¿Por qué es importante entender la estructura del átomo?
Entender la estructura del átomo es fundamental para comprender las propiedades de la materia y cómo interactúa con el mundo que nos rodea. Esto es especialmente importante en la química y la física, donde el conocimiento de la estructura del átomo es esencial para el desarrollo de nuevos materiales y tecnologías.
¿Cómo se utilizan los modelos del átomo en la vida cotidiana?
Los modelos del átomo se utilizan en la vida cotidiana de muchas maneras, desde el diseño de nuevos materiales hasta la fabricación de dispositivos electrónicos. También se utilizan en la medicina para desarrollar nuevos tratamientos y en la agricultura para mejorar la producción de cultivos.
¿Cómo se pueden mejorar los modelos del átomo en el futuro?
Los modelos del átomo seguirán evolucionando en el futuro a medida que nuestra comprensión de la física y la química avance. Uno de los desafíos actuales es desarrollar modelos que puedan describir cómo los átomos interactúan con su entorno en condiciones extremas, como en la alta presión y temperatura en el interior de las estrellas.
¿Qué papel juega la tecnología en la modelación del átomo?
La tecnología juega un papel fundamental en la modelación del átomo, desde los experimentos de rayos catódicos de Thomson hasta los superordenadores que se utilizan para simular la estructura de la

Deja una respuesta