Numero de atomos de cloro en 0.80 mol de cl2
Los átomos de cloro son un elemento químico muy importante que se encuentra en la tabla periódica. El cloro es un gas venenoso de color amarillo verdoso que se encuentra en la naturaleza en forma de compuestos químicos. Es ampliamente utilizado en la fabricación de productos químicos, como el PVC, el blanqueamiento de papel y la desinfección del agua.
Ahora, si se tiene una muestra de 0.80 mol de Cl2, la pregunta es: ¿cuántos átomos de cloro hay en esa muestra?
Para responder a esta pregunta, primero debemos entender la composición de la molécula de cloro. El Cl2 es una molécula diatómica, lo que significa que está compuesta por dos átomos de cloro unidos por un enlace covalente. Por lo tanto, para determinar el número de átomos de cloro en 0.80 mol de Cl2, debemos multiplicar la cantidad de moles por el número de átomos en una molécula de Cl2.
Cada molécula de Cl2 contiene 2 átomos de cloro. Por lo tanto, en 0.80 mol de Cl2 hay un total de 0.80 x 2 = 1.6 moles de átomos de cloro.
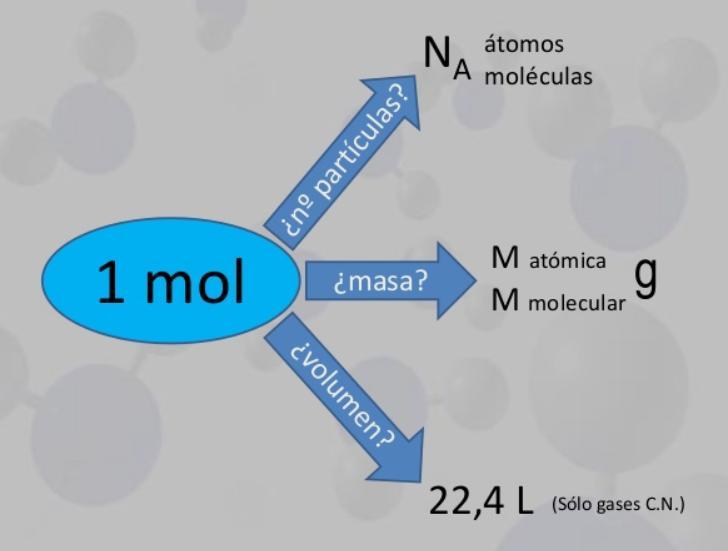
Como sabemos que un mol de una sustancia contiene aproximadamente 6.02 x 10^23 partículas (átomos, moléculas, iones, etc.), podemos utilizar esta constante para calcular el número de átomos de cloro en 0.80 mol de Cl2.
1.6 moles de átomos de cloro x 6.02 x 10^23 átomos/mol = 9.632 x 10^23 átomos de cloro
Por lo tanto, en 0.80 mol de Cl2 hay aproximadamente 9.632 x 10^23 átomos de cloro.
En resumen, Para determinar el número de átomos de cloro en 0.80 mol de Cl2, debemos multiplicar la cantidad de moles por el número de átomos en una molécula de Cl2 y luego utilizar la constante de Avogadro para convertir moles a número de átomos.
Tabla comparativa de moles y número de átomos de cloro
A continuación, se presenta una tabla comparativa que muestra el número de moles y el número de átomos de cloro en diferentes cantidades de Cl2.
| Cantidad de Cl2 | Número de moles | Número de átomos de cloro |
|---|---|---|
| 0.50 mol | 1.00 | 6.02 x 10^23 |
| 0.80 mol | 1.60 | 9.632 x 10^23 |
| 1.00 mol | 2.00 | 1.2044 x 10^24 |
| 2.00 mol | 4.00 | 2.4088 x 10^24 |
Preguntas frecuentes
¿Cuántos átomos de cloro hay en 1 mol de Cl2?
Cada molécula de Cl2 contiene 2 átomos de cloro, por lo que en 1 mol de Cl2 hay 2 átomos de cloro. Si se desea calcular el número total de átomos de cloro en 1 mol de Cl2, se debe multiplicar el número de moles por la constante de Avogadro (6.02 x 10^23).
¿Cómo se calcula el número de moles de una sustancia?
El número de moles de una sustancia se calcula dividiendo la masa de la sustancia por su masa molar. La masa molar es la masa de un mol de átomos, moléculas o iones de una sustancia. La fórmula para calcular el número de moles es:
Número de moles = masa de la sustancia (g) / masa molar (g/mol)
¿Qué es la constante de Avogadro?
La constante de Avogadro es el número de partículas (átomos, moléculas, iones, etc.) en un mol de una sustancia. Su valor es aproximadamente 6.02 x 10^23 partículas/mol.
¿Qué es una molécula diatómica?
Una molécula diatómica es una molécula que está compuesta por dos átomos del mismo elemento unidos por un enlace covalente. Algunos ejemplos de moléculas diatómicas son el oxígeno (O2), el nitrógeno (N2) y el cloro (Cl2).
¿Por qué es importante conocer el número de átomos de cloro en una muestra de Cl2?
Conocer el número de átomos de cloro en una muestra de Cl2 es importante en muchos contextos, como en la industria química y en la investigación científica. Por ejemplo, en la fabricación de PVC, el cloro es un componente clave en la producción de la resina de PVC. Conocer la cantidad de cloro en una muestra de Cl2 es esencial para calcular las cantidades adecuadas de los diferentes componentes necesarios para producir el PVC de alta calidad.

Deja una respuesta