Numero de oxidacion de los elementos de la tabla periodica
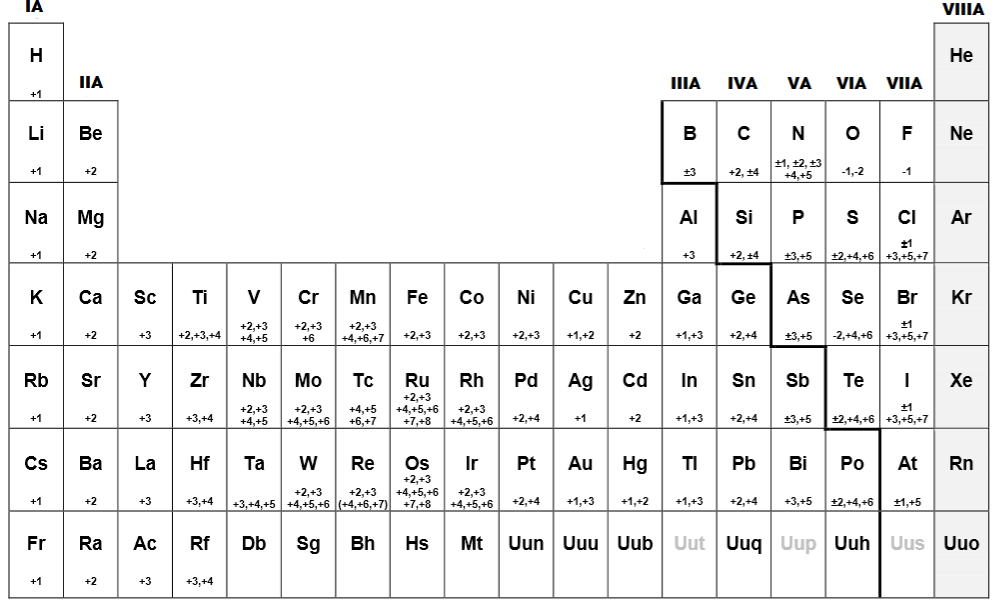
La tabla periódica es una herramienta fundamental para la comprensión de la química, y uno de los aspectos más importantes de los elementos que la componen es su número de oxidación. Este número es crucial para entender cómo los átomos se combinan y forman moléculas, y cómo estas reacciones químicas afectan a nuestro mundo.
En este artículo, te explicaremos qué es el número de oxidación, cómo se determina, y algunos ejemplos de elementos comunes y su número de oxidación. Además, te hablaremos sobre cómo los números de oxidación pueden ayudarnos a entender las reacciones químicas, y te daremos algunas aplicaciones prácticas de esta información.
¿Qué es el número de oxidación?
El número de oxidación es una forma de describir la carga que un átomo tiene en una molécula. Cada átomo tiene un número de electrones en su capa externa, y cuando se combina con otros átomos, estos electrones se pueden compartir o transferir de un átomo a otro. El número de oxidación se refiere a cuántos electrones ha ganado o perdido un átomo en una reacción química.
Por ejemplo, cuando un átomo de sodio se combina con un átomo de cloro para formar cloruro de sodio (sal de mesa), el sodio pierde un electrón y el cloro gana uno. El sodio ahora tiene un número de oxidación de +1, ya que ha perdido un electrón, y el cloro tiene un número de oxidación de -1, ya que ha ganado uno.
¿Cómo se determina el número de oxidación?
Para determinar el número de oxidación de un átomo en una molécula, hay que tener en cuenta la estructura de la molécula y la posición del átomo en ella. Los átomos en las moléculas pueden tener diferentes números de oxidación dependiendo de su posición y de los otros átomos con los que se combinan.
Existen algunas reglas generales que se pueden seguir para determinar el número de oxidación de un átomo en una molécula:
- Los átomos en su estado elemental (como el oxígeno O2 o el nitrógeno N2) tienen un número de oxidación de 0.
- Los iones monoatómicos (como Na+ o Cl-) tienen un número de oxidación igual a su carga.
- Los átomos en un compuesto neutro (como el agua H2O o el dióxido de carbono CO2) tienen un número de oxidación que se suma a cero.
- Los átomos de hidrógeno suelen tener un número de oxidación de +1.
- Los átomos de oxígeno suelen tener un número de oxidación de -2, excepto en peróxidos (como el peróxido de hidrógeno H2O2) donde su número de oxidación es -1.
Ejemplos de números de oxidación
Aquí hay algunos ejemplos de elementos comunes y su número de oxidación en diferentes moléculas:
- Oxígeno (O): -2 en la mayoría de los compuestos, pero puede tener un número de oxidación de -1 en peróxidos.
- Hidrógeno (H): +1 en la mayoría de los compuestos.
- Carbono (C): +4 en dióxido de carbono (CO2), -4 en metano (CH4).
- Nitrógeno (N): +5 en nitrato (NO3-), -3 en amoníaco (NH3).
- Hierro (Fe): +2 en óxido ferroso (FeO), +3 en óxido férrico (Fe2O3).
Aplicaciones prácticas del número de oxidación
El número de oxidación es una herramienta útil para entender cómo los átomos se combinan y reaccionan en diferentes situaciones. Los números de oxidación pueden ayudarnos a:
- Predicción de reacciones químicas: Al conocer los números de oxidación de los átomos en una molécula, podemos predecir cómo se combinarán con otros átomos y qué productos se formarán.
- Balancear ecuaciones químicas: Al balancear una ecuación química, es necesario asegurarse de que la cantidad de átomos y cargas en el lado izquierdo sea igual a la del lado derecho. Conociendo los números de oxidación de los átomos en la molécula, podemos asegurarnos de que la ecuación esté balanceada correctamente.
- Comprender la corrosión: La corrosión es el proceso por el cual los metales se oxidan y se descomponen debido a reacciones químicas con el medio ambiente. Al conocer los números de oxidación de los átomos en la superficie del metal, podemos entender cómo se produce la corrosión y cómo prevenirla.
- Diseñar medicamentos: La mayoría de los medicamentos funcionan al interactuar con moléculas específicas en el cuerpo. Al conocer los números de oxidación de los átomos en estas moléculas, los químicos pueden diseñar medicamentos que interactúen de manera específica con estas moléculas y produzcan los efectos deseados.
Preguntas frecuentes sobre el número de oxidación
1. ¿Qué es la oxidación?
La oxidación es el proceso por el cual un átomo pierde electrones y, por lo tanto, aumenta su número de oxidación. La oxidación es el proceso opuesto a la reducción, en el que un átomo gana electrones y disminuye su número de oxidación.
2. ¿Por qué es importante conocer el número de oxidación?
El número de oxidación es importante porque nos ayuda a entender cómo los átomos se combinan y reaccionan en diferentes situaciones. Conociendo los números de oxidación de los átomos en una molécula, podemos predecir cómo se combinarán con otros átomos y qué productos se formarán.
3. ¿Cómo se determina el número de oxidación de un átomo en una molécula?
Para determinar el número de oxidación de un átomo en una molécula, hay que tener en cuenta la estructura de la molécula y la posición del átomo en ella. Los átomos en las moléculas pueden tener diferentes números de oxidación dependiendo de su posición y de los otros átomos con los que se combinan.
4. ¿Por qué los átomos de hidrógeno tienen un número de oxidación de +1?
Los átomos de hidrógeno suelen tener un número de oxidación de +1 porque pierden un electrón cuando se combinan con otros átomos. En la mayoría de los compuestos, los átomos de hidrógeno tienen un electrón en su capa externa, y al compartirlo con otros átomos, pierden ese electrón y adquieren un número de oxidación de +1.
5. ¿Qué es un peróxido?
Un peróxido es un compuesto químico que contiene el grupo funcional -O-O-. Los peróxidos suelen tener un número de oxidación de

Deja una respuesta