Porque una disolucion de azucar en agua no conduce electricidad
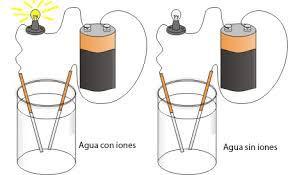
Cuando disolvemos azúcar en agua, la solución resultante no conduce electricidad. ¿Por qué? La respuesta se encuentra en la estructura molecular de la azúcar y el agua.
Primero, es importante entender que la electricidad se transmite a través de la corriente de electrones. En una solución acuosa, los iones libres son responsables de la conducción de la electricidad. Los iones son átomos o moléculas cargadas eléctricamente, que pueden moverse libremente en una solución acuosa.
En la disolución de azúcar en agua, la azúcar se disuelve en agua debido a la capacidad de la molécula de agua para interactuar con la molécula de azúcar y romper sus enlaces. Sin embargo, la molécula de azúcar no se disocia en iones, lo que significa que no hay iones libres en la solución para conducir electricidad.
En cambio, la molécula de azúcar se mantiene intacta en la solución acuosa, rodeada por moléculas de agua. Esta interacción entre la azúcar y el agua se debe a la polaridad de la molécula de agua. El agua es un compuesto polar, lo que significa que tiene una región cargada positivamente y otra negativamente. Debido a esta polaridad, la molécula de agua es capaz de interactuar con la molécula de azúcar y disolverla.
Para comparar esta situación con una solución que sí conduce electricidad, podemos tomar como ejemplo la disolución de sal en agua. Cuando disolvemos sal en agua, la molécula de sal se disocia en iones de sodio y cloruro. Los iones libres de sodio y cloruro pueden moverse libremente en la solución acuosa, lo que permite la conducción de la electricidad.
En resumen, Una disolución de azúcar en agua no conduce electricidad porque la molécula de azúcar no se disocia en iones, lo que significa que no hay iones libres en la solución para conducir la electricidad. En cambio, la molécula de azúcar se mantiene intacta en la solución acuosa, rodeada por moléculas de agua.
- ¿Cómo podemos comprobar que una disolución de azúcar en agua no conduce electricidad?
- ¿Por qué algunas soluciones como la sal y el ácido clorhídrico sí conducen electricidad?
- ¿Qué otras sustancias pueden disolverse en agua sin conducir electricidad?
- ¿Por qué es importante entender la conducción eléctrica en soluciones acuosas?
- ¿Cómo podemos mejorar la conducción eléctrica en soluciones acuosas?
¿Cómo podemos comprobar que una disolución de azúcar en agua no conduce electricidad?
Para comprobar si una solución conduce electricidad, podemos utilizar un circuito eléctrico simple. Si la solución conduce electricidad, se producirá una corriente eléctrica y se encenderá una bombilla o se escuchará un sonido. Si la solución no conduce electricidad, no habrá corriente eléctrica y la bombilla no se encenderá ni se escuchará ningún sonido.
¿Por qué algunas soluciones como la sal y el ácido clorhídrico sí conducen electricidad?
Las soluciones como la sal y el ácido clorhídrico contienen iones libres que pueden moverse libremente en la solución acuosa, lo que permite la conducción de la electricidad. En el caso de la sal, los iones de sodio y cloruro se disocian en la solución acuosa, mientras que en el caso del ácido clorhídrico, los iones de hidrógeno y cloruro se disocian en la solución acuosa.
¿Qué otras sustancias pueden disolverse en agua sin conducir electricidad?
Además de la azúcar, otras sustancias que no se disocian en iones y, por lo tanto, no conducen electricidad en solución acuosa incluyen el almidón, el aceite y la gasolina.
¿Por qué es importante entender la conducción eléctrica en soluciones acuosas?
La comprensión de la conducción eléctrica en soluciones acuosas es importante en muchos campos, incluyendo la química, la física y la biología. Por ejemplo, la electroquímica se utiliza para estudiar la reactividad de los compuestos en solución acuosa y para desarrollar tecnologías como las baterías recargables.
En biología, las soluciones acuosas son un componente esencial de la célula y el cuerpo humano. La conducción eléctrica en soluciones acuosas juega un papel importante en la transmisión de señales nerviosas y en la contracción muscular.
¿Cómo podemos mejorar la conducción eléctrica en soluciones acuosas?
La conducción eléctrica en soluciones acuosas puede mejorarse agregando sales u otros electrólitos a la solución. Estos compuestos se disocian en iones en solución acuosa y, por lo tanto, aumentan la cantidad de iones libres disponibles para conducir la electricidad.
En resumen, La disolución de azúcar en agua no conduce electricidad debido a la estructura molecular de la azúcar y el agua. La azúcar no se disocia en iones, lo que significa que no hay iones libres en la solución para conducir la electricidad. La comprensión de la conducción eléctrica en soluciones acuosas es importante en muchos campos y puede mejorarse agregando sales u otros electrólitos a la solución.

Deja una respuesta