Principios de la termodinamica primer principio de la termodinamica
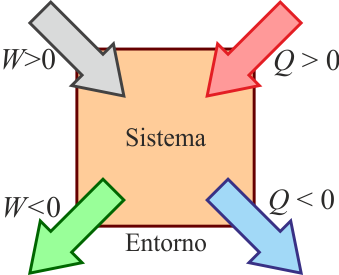
La termodinámica es una rama de la física que se encarga de estudiar la transferencia de energía y su relación con la materia. En este artículo, nos enfocaremos en el primer principio de la termodinámica, el cual se basa en la conservación de la energía.
¿Qué es el primer principio de la termodinámica?
El primer principio de la termodinámica establece que la energía no se crea ni se destruye, solo se transforma de una forma a otra. En otras palabras, la cantidad total de energía en un sistema cerrado permanece constante. Este principio se conoce como el principio de conservación de la energía.
Ejemplos del primer principio de la termodinámica
Un ejemplo del primer principio de la termodinámica es el proceso de calentar agua en una olla. La energía térmica se transfiere de la fuente de calor a la olla y al agua, aumentando la temperatura del agua. Si bien la energía térmica se ha transferido, la cantidad total de energía en el sistema (la olla, el agua y la fuente de calor) sigue siendo la misma.
Otro ejemplo es la energía eléctrica que se utiliza para encender una bombilla. La energía eléctrica se transforma en energía lumínica y térmica, pero la cantidad total de energía en el sistema permanece constante.
Relación entre el primer principio de la termodinámica y la ley de conservación de la energía
El primer principio de la termodinámica es una aplicación práctica de la ley de conservación de la energía en sistemas termodinámicos. La ley de conservación de la energía establece que la energía total en un sistema aislado es constante, mientras que el primer principio de la termodinámica se enfoca en cómo se transfiere y cambia la energía en sistemas abiertos y cerrados.
El primer principio de la termodinámica en la vida cotidiana
El primer principio de la termodinámica se aplica en muchos aspectos de nuestra vida cotidiana, desde la cocción de alimentos hasta el funcionamiento de los motores de combustión interna en vehículos. Todos estos procesos implican la transferencia y conversión de energía, pero la cantidad total de energía en el sistema permanece constante.
Conclusión
El primer principio de la termodinámica es un concepto fundamental en la física y se basa en la conservación de la energía en sistemas termodinámicos. Este principio se aplica en muchos aspectos de nuestra vida cotidiana y es esencial para comprender cómo funciona el mundo físico que nos rodea.
Preguntas frecuentes
1. ¿El primer principio de la termodinámica se aplica solo a sistemas cerrados?
No, el primer principio de la termodinámica se aplica tanto a sistemas abiertos como a sistemas cerrados. En un sistema cerrado, la cantidad total de energía se mantiene constante, mientras que en un sistema abierto, la energía puede entrar y salir del sistema.
2. ¿El primer principio de la termodinámica se aplica solo a la transferencia de energía térmica?
No, el primer principio de la termodinámica se aplica a cualquier forma de energía, incluyendo la energía mecánica, eléctrica y química.
3. ¿Cómo se relaciona el primer principio de la termodinámica con la entalpía?
La entalpía es una medida de la cantidad de energía en un sistema a presión constante. El primer principio de la termodinámica establece que la energía total en un sistema cerrado es constante, por lo que cualquier cambio en la entalpía de un sistema debe estar equilibrado por un cambio en la energía interna o en el trabajo realizado por o sobre el sistema.
4. ¿Qué es un sistema termodinámico?
Un sistema termodinámico es cualquier conjunto de materia y energía que se puede estudiar desde un punto de vista termodinámico. Puede ser un objeto pequeño, como un vaso de agua caliente, o un sistema más grande, como una fábrica que utiliza energía térmica para generar electricidad.
5. ¿Qué es un sistema cerrado?
Un sistema cerrado es aquel en el que no hay intercambio de materia con el entorno, pero sí puede haber intercambio de energía. La cantidad total de energía en un sistema cerrado se mantiene constante.

Deja una respuesta