Que dice la ley de la conservacion de la masa
La ley de la conservación de la masa es uno de los principios fundamentales de la química y de la física. Esta ley establece que, en cualquier proceso químico o físico, la masa total de los reactivos es igual a la masa total de los productos. En otras palabras, la masa no se crea ni se destruye, solo se transforma.
Esta ley fue formulada por el químico francés Antoine Lavoisier en el siglo XVIII. Lavoisier realizó experimentos en los que medía la masa de los reactivos antes y después de una reacción química y siempre encontraba que la masa total era la misma. A partir de estos experimentos, Lavoisier concluyó que la materia no se creaba ni se destruía, sino que se transformaba.
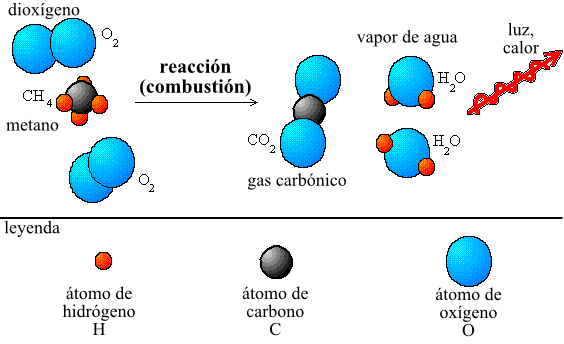
La ley de la conservación de la masa se aplica en todo tipo de procesos químicos y físicos, desde la combustión de un combustible hasta la respiración de los seres vivos. En todos estos procesos, la masa total de los reactivos es igual a la masa total de los productos.
Por ejemplo, en la combustión del propano (C3H8) en presencia de oxígeno (O2), se produce dióxido de carbono (CO2) y agua (H2O). La ecuación química de esta reacción es:
C3H8 + 5O2 → 3CO2 + 4H2O
Según la ley de la conservación de la masa, la masa total de los reactivos (propano y oxígeno) es igual a la masa total de los productos (dióxido de carbono y agua). En este caso, la masa total de los reactivos es de 44,1 gramos (28,05 gramos de propano y 16,05 gramos de oxígeno) y la masa total de los productos es de 44,1 gramos (24,03 gramos de dióxido de carbono y 20,08 gramos de agua).
La ley de la conservación de la masa es una ley fundamental en la química y la física porque establece una regla básica para todos los procesos en los que la materia se transforma. Esta ley se utiliza para realizar cálculos en la química y la física y es esencial para entender cómo se producen y se transforman los materiales.
Tabla comparativa
Una forma de entender mejor la ley de la conservación de la masa es comparando las masas de los reactivos y los productos en una tabla. Por ejemplo, en la siguiente tabla se muestran las masas de los reactivos y los productos en la reacción de la combustión del propano:
| Reactivos | Productos |
|---|---|
| 28,05 g de C3H8 | 24,03 g de CO2 |
| 16,05 g de O2 | 20,08 g de H2O |
| Total: 44,1 g | Total: 44,1 g |
Como se puede ver en la tabla, la masa total de los reactivos es igual a la masa total de los productos, cumpliendo así la ley de la conservación de la masa.
¿Cómo se aplica la ley de la conservación de la masa en la vida diaria?
La ley de la conservación de la masa se aplica en muchos aspectos de la vida diaria. Por ejemplo, en la cocina, cuando se cocina un huevo, la masa total del huevo antes de cocinarlo es la misma que después de cocinarlo, aunque su apariencia y sus propiedades hayan cambiado.
También se aplica en la fabricación de materiales, como el papel. En este proceso, la madera se convierte en pulpa y luego se seca para formar hojas de papel. La masa total de la pulpa de madera es la misma que la masa total del papel producido, cumpliendo así la ley de la conservación de la masa.
¿Qué sucede si la ley de la conservación de la masa no se cumple?
Si la ley de la conservación de la masa no se cumple, significa que hay un error en los cálculos o en la medición de las masas de los reactivos y los productos. Esto puede llevar a resultados incorrectos en experimentos y procesos químicos, lo que puede tener consecuencias graves. Por esta razón, es esencial asegurarse de que se cumpla la ley de la conservación de la masa en todos los procesos químicos y físicos.
¿Cómo se relaciona la ley de la conservación de la masa con la energía?
La ley de la conservación de la masa se relaciona con la ley de la conservación de la energía, que establece que la energía no se crea ni se destruye, solo se transforma. En muchos procesos químicos y físicos, la masa y la energía están relacionadas y se transforman juntas. Por ejemplo, en la combustión del propano, la energía liberada por la reacción se puede medir a través de la cantidad de calor producido y se relaciona con la masa de los reactivos y los productos.
Conclusión
La ley de la conservación de la masa es un principio fundamental en la química y la física que establece que la masa total de los reactivos es igual a la masa total de los productos en cualquier proceso químico o físico. Esta ley se aplica en todo tipo de procesos, desde la combustión de un combustible hasta la respiración de los seres vivos. Es esencial para realizar cálculos y entender cómo se producen y se transforman los materiales. Además, se relaciona con la ley de la conservación de la energía y es esencial para garantizar la precisión en los experimentos y procesos químicos.

Deja una respuesta