Que tienen en comun los elementos de un mismo grupo
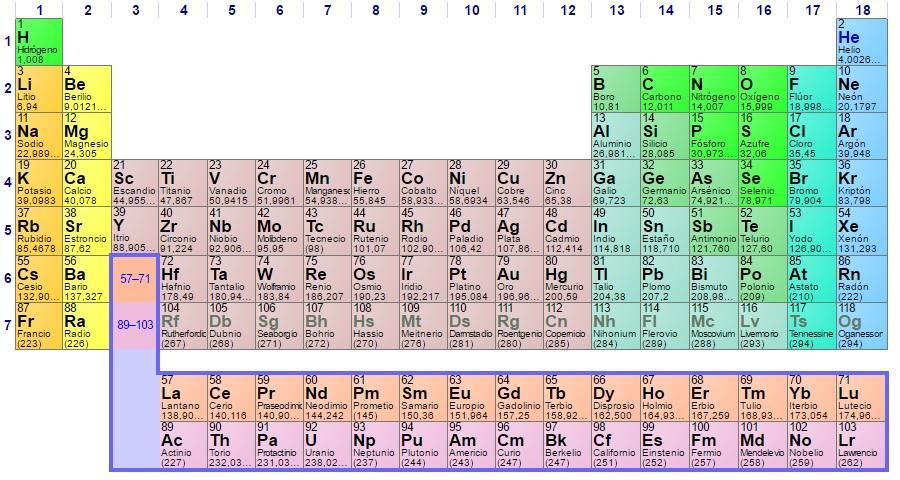
Cuando se estudia la tabla periódica de los elementos, es fácil notar que los elementos están organizados en filas y columnas. Las filas se llaman períodos, mientras que las columnas se llaman grupos o familias. Dentro de un mismo grupo, los elementos tienen algunas características en común. En este artículo, exploraremos qué tienen en común los elementos de un mismo grupo.
Los grupos de la tabla periódica
Primero, es importante entender cómo están organizados los grupos en la tabla periódica. Hay 18 grupos en total, numerados del 1 al 18. Los grupos se dividen en tres categorías principales:
- Grupo 1: metales alcalinos
- Grupo 2: metales alcalinotérreos
- Grupos 3-12: metales de transición
- Grupo 13: grupo del boro
- Grupo 14: grupo del carbono
- Grupo 15: grupo del nitrógeno
- Grupo 16: grupo del oxígeno
- Grupo 17: halógenos
- Grupo 18: gases nobles
Propiedades físicas y químicas
Dentro de un mismo grupo, los elementos tienen propiedades físicas y químicas similares. Esto se debe a que tienen la misma cantidad de electrones en su capa externa. Los electrones de la capa externa determinan cómo los átomos interactúan con otros átomos y moléculas.
Por ejemplo, los metales alcalinos (grupo 1) son conocidos por ser muy reactivos y reaccionar fácilmente con el agua y otros compuestos. Esto se debe a que tienen un solo electrón en su capa externa, lo que los hace altamente reactivos. Los gases nobles (grupo 18), por otro lado, son muy estables y no reaccionan fácilmente con otros elementos. Esto se debe a que tienen una capa externa completa de electrones.
Tamaño atómico
Otra propiedad que tienen en común los elementos de un mismo grupo es el tamaño atómico. El tamaño atómico se refiere al tamaño del átomo, que está determinado por el número de electrones y protones que tiene. Dentro de un mismo grupo, el tamaño atómico aumenta a medida que se mueve hacia abajo en la tabla periódica.
Por ejemplo, el litio (Li) es el elemento más pequeño del grupo 1, mientras que el cesio (Cs) es el elemento más grande. Esto se debe a que el número de electrones y protones aumenta a medida que se mueve hacia abajo en el grupo.
Electronegatividad
La electronegatividad es otra propiedad que tienen en común los elementos de un mismo grupo. La electronegatividad se refiere a la capacidad de un átomo para atraer electrones hacia sí mismo. Dentro de un mismo grupo, la electronegatividad disminuye a medida que se mueve hacia abajo en la tabla periódica.
Por ejemplo, el flúor (F) es el elemento más electronegativo del grupo 17, mientras que el yodo (I) es el menos electronegativo. Esto se debe a que los átomos más grandes tienen una mayor distancia entre su núcleo y sus electrones de valencia, lo que los hace menos atractivos para los electrones.
Comparación con tablas
Podemos hacer una analogía entre los grupos de la tabla periódica y las tablas. Al igual que en la tabla periódica, las tablas también están organizadas en filas y columnas. Dentro de una misma columna, las celdas tienen características similares, mientras que las celdas en diferentes columnas tienen diferentes características.
En una tabla HTML, podemos aplicar estilos a una columna completa en lugar de aplicar estilos a cada celda individual. Del mismo modo, en la química, podemos aplicar propiedades a todo un grupo en lugar de aplicarlas a cada elemento individual.
Preguntas frecuentes
¿Por qué los elementos de un mismo grupo tienen propiedades similares?
Los elementos de un mismo grupo tienen propiedades similares porque tienen la misma cantidad de electrones en su capa externa. Los electrones de la capa externa determinan cómo los átomos interactúan con otros átomos y moléculas.
¿Por qué el tamaño atómico aumenta hacia abajo en un grupo?
El tamaño atómico aumenta hacia abajo en un grupo porque el número de electrones y protones aumenta a medida que se mueve hacia abajo en el grupo. Esto hace que el átomo sea más grande.
¿Por qué la electronegatividad disminuye hacia abajo en un grupo?
La electronegatividad disminuye hacia abajo en un grupo porque los átomos más grandes tienen una mayor distancia entre su núcleo y sus electrones de valencia, lo que los hace menos atractivos para los electrones.
¿Por qué los gases nobles son tan estables?
Los gases nobles son tan estables porque tienen una capa externa completa de electrones. Esto significa que no necesitan compartir o perder electrones para alcanzar una configuración estable de la capa externa.
¿Qué es la electronegatividad?
La electronegatividad se refiere a la capacidad de un átomo para atraer electrones hacia sí mismo.

Deja una respuesta