Representa el cambio de energia interna en una reaccion endotermica
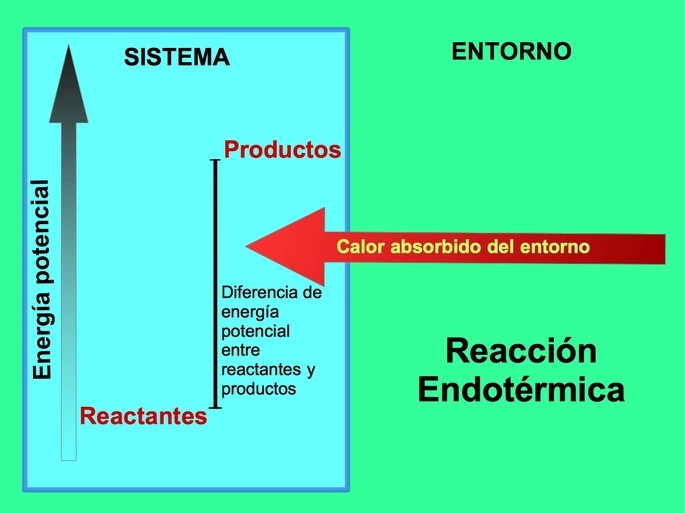
Cuando dos sustancias reaccionan entre sí, pueden liberar o absorber energía. Cuando se absorbe energía, se dice que la reacción es endotérmica. En este tipo de reacciones, la energía se toma del entorno y se utiliza para romper enlaces químicos y formar nuevos. Pero ¿cómo se representa el cambio de energía interna en una reacción endotérmica?
Para entenderlo, primero debemos hablar sobre la energía interna de una sustancia. La energía interna es la energía que una sustancia posee debido a la vibración y movimiento de sus moléculas y átomos. En una reacción química, la energía interna de las sustancias involucradas cambia debido a la formación o ruptura de enlaces químicos.
En una reacción endotérmica, la energía interna de las sustancias aumenta a medida que absorben energía del entorno. Esto significa que la energía de los productos es mayor que la energía de los reactivos. Para representar este cambio de energía interna, se utiliza una ecuación de cambio de entalpía (ΔH).
La ecuación de cambio de entalpía representa la diferencia entre la energía de los productos y la energía de los reactivos. Si la ecuación es positiva, significa que la reacción es endotérmica y que se ha absorbido energía. Si es negativa, significa que la reacción es exotérmica y que se ha liberado energía.
La ecuación de cambio de entalpía se puede calcular utilizando la ley de Hess, que establece que la entalpía total de una reacción química es independiente de la ruta que se siga para llegar a los productos. En otras palabras, la energía necesaria para formar los productos es la misma, independientemente de cómo se llegue a ellos.
Para calcular la ecuación de cambio de entalpía de una reacción endotérmica, se suman las entalpías de los productos y se restan las entalpías de los reactivos. El resultado es la ΔH de la reacción.
Por ejemplo, la reacción de descomposición del carbonato de calcio en óxido de calcio y dióxido de carbono es endotérmica. La ecuación química de esta reacción es:
CaCO3(s) → CaO(s) + CO2(g)
Para calcular la ΔH de esta reacción, necesitamos las entalpías de formación de los productos y los reactivos. La entalpía de formación es la cantidad de energía necesaria para formar una sustancia a partir de sus elementos en su forma más estable.
La entalpía de formación del carbonato de calcio es -1207 kJ/mol, la del óxido de calcio es -635 kJ/mol y la del dióxido de carbono es -393,5 kJ/mol. Sustituyendo estos valores en la ecuación de cambio de entalpía, obtenemos:
ΔH = (ent. de form. CaO + ent. de form. CO2) - ent. de form. CaCO3
ΔH = (-635 kJ/mol + (-393,5 kJ/mol)) - (-1207 kJ/mol)
ΔH = 178,5 kJ/mol
Este resultado indica que la reacción es endotérmica, ya que se ha absorbido energía para formar los productos.
En resumen, El cambio de energía interna en una reacción endotérmica se representa mediante la ecuación de cambio de entalpía. Esta ecuación se calcula sumando las entalpías de los productos y restando las entalpías de los reactivos. Si el resultado es positivo, significa que la reacción es endotérmica y que se ha absorbido energía del entorno. La ley de Hess se utiliza para calcular la ecuación de cambio de entalpía, y las entalpías de formación se utilizan para obtener los valores necesarios para el cálculo.

Deja una respuesta