Tercera ley de la termodinamica ejemplos de la vida cotidiana
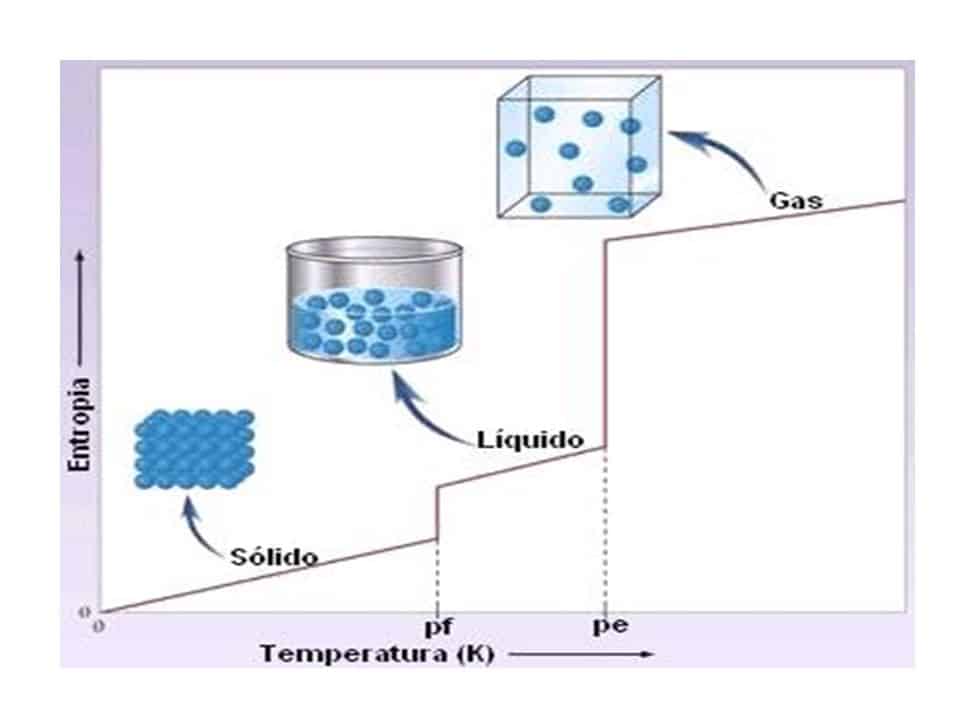
La tercera ley de la termodinámica es una de las leyes fundamentales de la física que se encarga de describir la entropía de un sistema a medida que se acerca al cero absoluto de temperatura. Esta ley tiene implicaciones importantes en la vida cotidiana, ya que nos ayuda a entender cómo funciona el mundo que nos rodea. En este artículo, exploraremos algunos ejemplos de la tercera ley de la termodinámica en la vida cotidiana.
¿Qué es la tercera ley de la termodinámica?
Antes de adentrarnos en los ejemplos de la tercera ley de la termodinámica, es importante entender de qué se trata esta ley. La tercera ley establece que es imposible alcanzar el cero absoluto de temperatura mediante un número finito de procesos físicos. En otras palabras, no se puede alcanzar una temperatura de cero Kelvin (-273.15°C) mediante enfriamiento gradual.
Esta ley se basa en la idea de que la entropía de un sistema tiende a cero a medida que se acerca al cero absoluto de temperatura. La entropía es una medida de la cantidad de desorden o aleatoriedad en un sistema. A medida que la temperatura disminuye, la entropía también disminuye, lo que significa que el sistema se vuelve más ordenado y estructurado.
Ejemplos de la tercera ley de la termodinámica en la vida cotidiana
1. Congelación del agua: Uno de los ejemplos más comunes de la tercera ley de la termodinámica es la congelación del agua. Cuando el agua se enfría, su entropía disminuye y sus moléculas se vuelven más ordenadas. A medida que la temperatura se acerca a cero absoluto, la entropía de las moléculas de agua disminuye hasta que forman un cristal sólido.
2. Superconductividad: La superconductividad es otro ejemplo de la tercera ley de la termodinámica en acción. Los materiales superconductores tienen una resistencia eléctrica cercana a cero cuando se enfrían a temperaturas extremadamente bajas. Esto se debe a que la entropía del sistema disminuye a medida que se acerca al cero absoluto de temperatura.
3. Cristalización de metales: La cristalización de metales es otro ejemplo de la tercera ley de la termodinámica en la vida cotidiana. Cuando se funde un metal, sus átomos se encuentran en un estado desordenado y aleatorio. Sin embargo, a medida que el metal se enfría y se solidifica, los átomos se organizan en una estructura cristalina ordenada y estructurada.
4. Enfriamiento de alimentos: El enfriamiento de los alimentos es otro ejemplo de la tercera ley de la termodinámica en la vida cotidiana. Cuando se enfría un alimento, la entropía del sistema disminuye y las moléculas se vuelven más ordenadas. Esto puede ayudar a preservar los alimentos por más tiempo y reducir el riesgo de crecimiento de bacterias y otros microorganismos.
5. Solidificación del vidrio: La solidificación del vidrio es otro ejemplo interesante de la tercera ley de la termodinámica. A diferencia de los metales, el vidrio no tiene una estructura cristalina ordenada. Sin embargo, a medida que se enfría y se solidifica, las moléculas de vidrio se organizan en una estructura amorfa ordenada.
Conclusión
La tercera ley de la termodinámica es una ley fundamental de la física que tiene implicaciones importantes en la vida cotidiana. Desde la congelación del agua hasta la superconductividad, hay muchos ejemplos de esta ley en acción en el mundo que nos rodea. Al comprender cómo funciona la tercera ley, podemos tener una mejor comprensión del funcionamiento del mundo natural.
Preguntas frecuentes
1. ¿Qué es la entropía?
La entropía es una medida de la cantidad de desorden o aleatoriedad en un sistema.
2. ¿Qué es el cero absoluto?
El cero absoluto es la temperatura más baja posible, que es de -273.15°C.
3. ¿Por qué es importante la tercera ley de la termodinámica?
La tercera ley de la termodinámica nos ayuda a entender cómo se comportan los sistemas a medida que se enfrían y se acercan al cero absoluto de temperatura.
4. ¿Qué son los materiales superconductores?
Los materiales superconductores son aquellos que tienen una resistencia eléctrica cercana a cero cuando se enfrían a temperaturas extremadamente bajas.
5. ¿Qué es la cristalización de metales?
La cristalización de metales es el proceso por el cual los átomos de un metal se organizan en una estructura cristalina ordenada a medida que se enfrían y se solidifican.

Deja una respuesta