Efecto de la concentracion de sustrato en la actividad enzimatica
Las enzimas son proteínas que aceleran las reacciones químicas en los seres vivos. La actividad enzimática es crucial para el correcto funcionamiento del metabolismo. La velocidad de la reacción enzimática depende de varios factores, uno de los más importantes es la concentración de sustrato.
- ¿Qué es la concentración de sustrato?
- ¿Cómo afecta la concentración de sustrato en la actividad enzimática?
- ¿Qué es la constante de Michaelis-Menten?
- ¿Cómo se relaciona la concentración de sustrato con la constante de Michaelis-Menten?
- ¿Qué pasa si la concentración de sustrato es demasiado baja?
- ¿Qué pasa si la concentración de sustrato es demasiado alta?
- Conclusión
- Preguntas frecuentes
¿Qué es la concentración de sustrato?
La concentración de sustrato se refiere a la cantidad de moléculas de sustrato presentes en una solución. En una reacción enzimática, el sustrato es la molécula que es transformada por la enzima en un producto.
¿Cómo afecta la concentración de sustrato en la actividad enzimática?
La actividad enzimática aumenta a medida que aumenta la concentración de sustrato. Esto se debe a que a medida que hay más moléculas de sustrato, hay más posibilidades de que una molécula de sustrato colisione con una molécula de enzima y se produzca la reacción química.
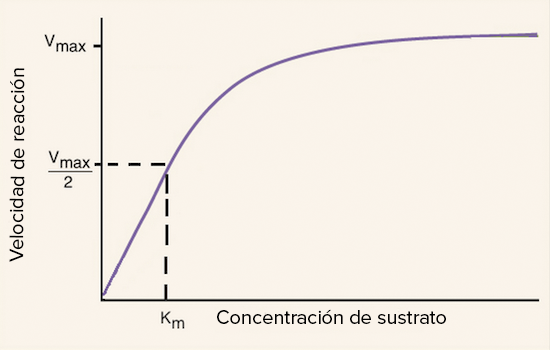
Sin embargo, una vez que todas las moléculas de enzima están unidas a moléculas de sustrato, la velocidad de la reacción enzimática se estabiliza y ya no aumenta. A este punto se le llama “la velocidad máxima de reacción” y se representa como Vmax. En otras palabras, la cantidad de enzima es un factor limitante en la velocidad de la reacción enzimática.
¿Qué es la constante de Michaelis-Menten?
La constante de Michaelis-Menten es una medida de la eficacia de una enzima. Se define como la concentración de sustrato a la que la velocidad de la reacción es la mitad de la velocidad máxima de reacción. Se representa como KM.
¿Cómo se relaciona la concentración de sustrato con la constante de Michaelis-Menten?
A medida que aumenta la concentración de sustrato, la velocidad de la reacción enzimática aumenta hasta que alcanza la velocidad máxima de reacción. La constante de Michaelis-Menten se mantiene constante hasta que la velocidad de la reacción enzimática alcanza la velocidad máxima de reacción. Después de este punto, la constante de Michaelis-Menten se vuelve irrelevante.
¿Qué pasa si la concentración de sustrato es demasiado baja?
Si la concentración de sustrato es demasiado baja, la velocidad de la reacción enzimática será lenta. Esto se debe a que hay menos posibilidades de que una molécula de sustrato colisione con una molécula de enzima. En este caso, la constante de Michaelis-Menten es útil para determinar la eficacia de la enzima.
¿Qué pasa si la concentración de sustrato es demasiado alta?
Si la concentración de sustrato es demasiado alta, todas las moléculas de enzima estarán unidas a moléculas de sustrato y la velocidad de la reacción enzimática se estabilizará. En este punto, la velocidad de la reacción enzimática dependerá de la cantidad de enzima presente en la solución.
Conclusión
En resumen, La concentración de sustrato es un factor importante en la actividad enzimática. A medida que aumenta la concentración de sustrato, la velocidad de la reacción enzimática aumenta hasta que alcanza la velocidad máxima de reacción. La constante de Michaelis-Menten es útil para determinar la eficacia de la enzima en diferentes concentraciones de sustrato.
En términos de programación web, podemos comparar la concentración de sustrato con una tabla HTML. Una tabla HTML es una estructura que tiene filas y columnas. Si agregamos más filas a la tabla, tendremos más datos y la tabla será más grande. De manera similar, si aumentamos la concentración de sustrato, tendremos más moléculas de sustrato en la solución y la velocidad de la reacción enzimática aumentará.
Por otro lado, la velocidad de la reacción enzimática se estabiliza una vez que todas las moléculas de enzima están unidas a las moléculas de sustrato, al igual que una tabla HTML tiene un número limitado de celdas. Una vez que todas las celdas están ocupadas, la tabla no puede contener más datos.
Preguntas frecuentes
¿Qué es una enzima?
Una enzima es una proteína que acelera las reacciones químicas en los seres vivos.
¿Cómo aceleran las enzimas las reacciones químicas?
Las enzimas aceleran las reacciones químicas al unirse a las moléculas de sustrato y reducir la energía de activación necesaria para la reacción química.
¿Cómo se mide la actividad enzimática?
La actividad enzimática se puede medir midiendo la velocidad de la reacción enzimática. Esto se puede hacer midiendo la cantidad de sustrato consumido o la cantidad de producto producido en un período de tiempo.
¿Qué es la velocidad máxima de reacción?
La velocidad máxima de reacción es la velocidad a la que la reacción enzimática alcanza su punto máximo. En este punto, todas las moléculas de enzima están unidas a moléculas de sustrato y la velocidad de la reacción se estabiliza.
¿Cómo afecta la temperatura y el pH en la actividad enzimática?
La temperatura y el pH pueden afectar la actividad enzimática. Cada enzima tiene un rango óptimo de temperatura y pH en el que es más eficaz. Si la temperatura o el pH están fuera de este rango, la actividad enzimática puede disminuir o detenerse por completo.

Deja una respuesta