Estructura de lewis del enlace covalente que hay en hcl
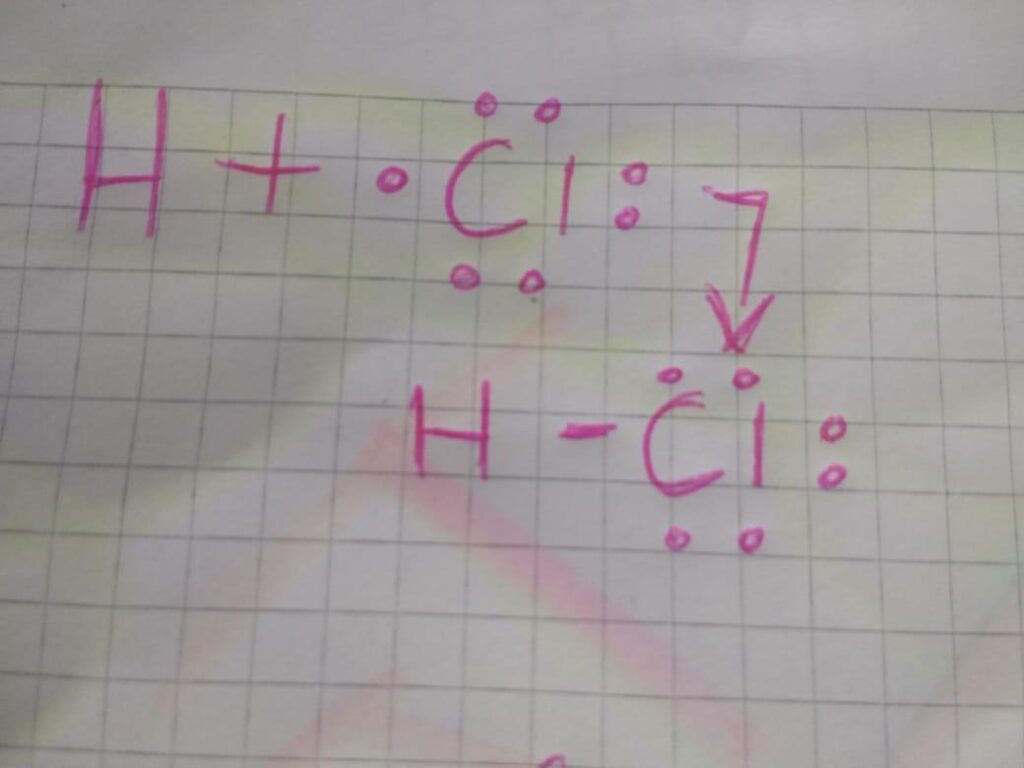
El ácido clorhídrico (HCl) es un compuesto químico que se forma a partir de la unión de un átomo de hidrógeno (H) y uno de cloro (Cl) mediante un enlace covalente. Este tipo de enlace se caracteriza por compartir electrones entre los átomos que lo forman, lo que determina la estructura de Lewis del compuesto.
La estructura de Lewis del enlace covalente que hay en HCl se puede representar mediante un diagrama que muestra los electrones de valencia de cada átomo y la forma en que se comparten a través del enlace. En el caso del HCl, el átomo de hidrógeno aporta un electrón y el átomo de cloro aporta siete, lo que da un total de ocho electrones de valencia. Estos ocho electrones se distribuyen en torno a los átomos de la siguiente manera:
- El átomo de hidrógeno tiene dos electrones, uno en su orbital 1s y otro en su orbital 2s.
- El átomo de cloro tiene siete electrones, dos en su orbital 2s y cinco en su orbital 2p.
Para que ambos átomos completen sus octetos, es decir, tengan ocho electrones en su capa de valencia, es necesario que compartan un par de electrones. Este par de electrones se sitúa en el espacio entre ambos átomos, formando un enlace covalente.
La estructura de Lewis del enlace covalente que hay en HCl se puede representar mediante un diagrama en el que se dibujan los átomos de hidrógeno y cloro, y se unen mediante una línea que representa el enlace covalente. Los electrones que forman el enlace se representan mediante puntos que se sitúan en el espacio entre ambos átomos, y se distribuyen de forma que cada átomo tenga ocho electrones en su capa de valencia.
En resumen, La estructura de Lewis del enlace covalente que hay en HCl se caracteriza por la compartición de un par de electrones entre el átomo de hidrógeno y el átomo de cloro, lo que permite que ambos átomos completen su octeto y formen una molécula estable.
Tabla comparativa de la estructura de Lewis del enlace covalente en diferentes compuestos
A continuación, se muestra una tabla comparativa de la estructura de Lewis del enlace covalente en diferentes compuestos:
| Compuesto | Estructura de Lewis |
|---|---|
| HCl | H:·Cl |
| H2O | H:·O:·H |
| CO2 | O:·C:·O |
En todos estos compuestos, se observa la compartición de electrones a través de enlaces covalentes, lo que permite a los átomos involucrados completar sus octetos y formar moléculas estables.
Listado de preguntas frecuentes sobre la estructura de Lewis del enlace covalente en HCl
1. ¿Qué es la estructura de Lewis?
La estructura de Lewis es una representación gráfica de la distribución de los electrones de valencia en un compuesto químico. Esta estructura se utiliza para entender mejor la forma en que los átomos se unen mediante enlaces covalentes, iónicos y metálicos.
2. ¿Qué es un enlace covalente?
Un enlace covalente es una fuerza que une dos átomos mediante la compartición de electrones de valencia. Este tipo de enlace se forma cuando dos átomos necesitan completar sus octetos y comparten electrones para lograrlo.
3. ¿Cómo se representa la estructura de Lewis del enlace covalente en HCl?
La estructura de Lewis del enlace covalente en HCl se representa mediante un diagrama en el que se dibujan los átomos de hidrógeno y cloro, y se unen mediante una línea que representa el enlace covalente. Los electrones que forman el enlace se representan mediante puntos que se sitúan en el espacio entre ambos átomos.
4. ¿Por qué es importante la estructura de Lewis del enlace covalente en HCl?
La estructura de Lewis del enlace covalente en HCl es importante porque nos permite entender mejor la forma en que los átomos se unen mediante enlaces covalentes y cómo se distribuyen los electrones de valencia en una molécula. Esto es fundamental para comprender las propiedades químicas de los compuestos y su comportamiento en diferentes situaciones.
5. ¿Qué otros compuestos presentan enlaces covalentes?
Existen muchos compuestos que presentan enlaces covalentes, como el agua (H2O), el dióxido de carbono (CO2), el metano (CH4), el oxígeno (O2) y el nitrógeno (N2), entre otros. En todos estos compuestos, los átomos se unen mediante la compartición de electrones de valencia para formar moléculas estables.

Deja una respuesta