Que tienen en comun los elementos de un mismo periodo
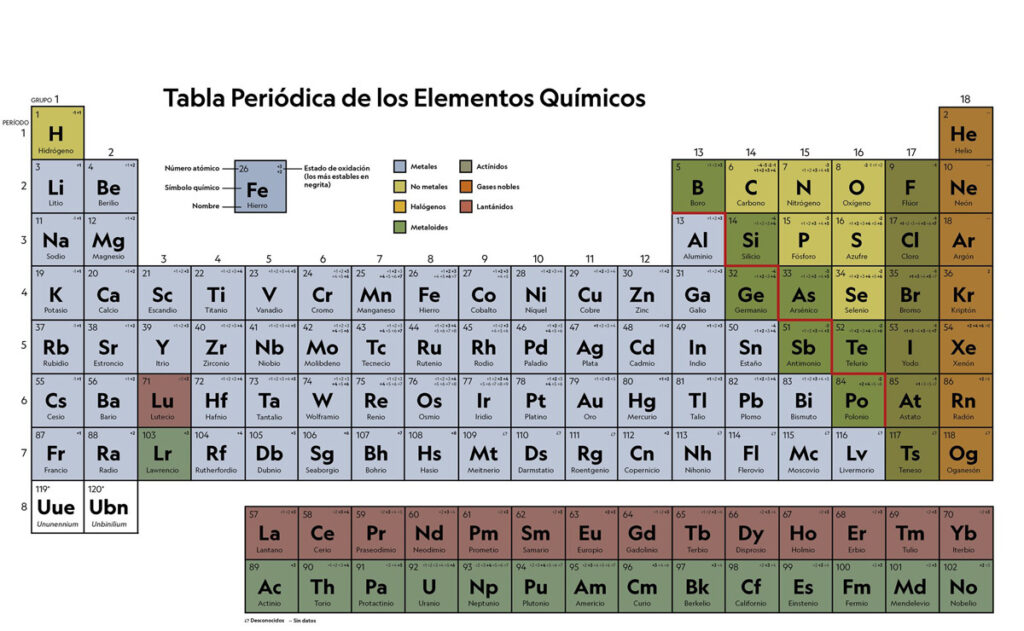
En la tabla periódica, los elementos están organizados en filas horizontales llamadas periodos. Estos periodos se enumeran del 1 al 7, y cada uno de ellos contiene elementos con propiedades químicas similares. Aunque los elementos de un mismo periodo pueden variar en su masa atómica y número de electrones, tienen algunas similitudes notables que los unen.
- 1. Mismo número de capas electrónicas
- 2. Misma cantidad de orbitales
- 3. Propiedades químicas similares
- 4. Tamaño atómico
- 5. Electronegatividad
- 6. Energía de ionización
- Conclusión
- Preguntas frecuentes
- 1. ¿Por qué los elementos de un mismo período tienen propiedades químicas similares?
- 2. ¿Por qué disminuye el tamaño atómico a medida que se mueve de izquierda a derecha en un período?
- 3. ¿Por qué aumenta la electronegatividad a medida que se mueve de izquierda a derecha en un período?
- 4. ¿Por qué aumenta la energía de ionización a medida que se mueve de izquierda a derecha en un período?
- 5. ¿Qué es una tabla periódica HTML?
1. Mismo número de capas electrónicas
Los elementos de un mismo periodo tienen el mismo número de capas electrónicas. En otras palabras, todos los elementos en el primer periodo (hidrógeno y helio) tienen solo una capa electrónica. En el segundo periodo (lítio, berílio, boro, carbono, nitrógeno, oxígeno, flúor y neón) todos tienen dos capas electrónicas, y así sucesivamente.
2. Misma cantidad de orbitales
Los elementos de un mismo periodo también tienen la misma cantidad de orbitales. En cada período, el número de orbitales aumenta en uno, lo que significa que los elementos de un mismo período tienen el mismo número de orbitales. Por ejemplo, en el primer período, los dos elementos que lo componen tienen un solo orbital, mientras que en el segundo periodo, los ocho elementos tienen dos orbitales.
3. Propiedades químicas similares
Los elementos de un mismo periodo tienen propiedades químicas similares. Esto se debe a que los electrones de valencia, que son los electrones más externos de un átomo, están ubicados en la misma capa electrónica y, por lo tanto, interactúan de manera similar con otros átomos. Por lo tanto, los elementos de un mismo periodo tienden a formar compuestos con elementos similares.
4. Tamaño atómico
Los elementos de un mismo período también tienen tamaños atómicos similares. A medida que se mueve de izquierda a derecha en un período, el tamaño atómico disminuye debido a una mayor atracción del núcleo sobre los electrones de valencia. Por lo tanto, los elementos del extremo izquierdo del período (como el sodio) tienen tamaños atómicos más grandes que los elementos del extremo derecho (como el flúor).
5. Electronegatividad
La electronegatividad es una medida de la capacidad de un átomo para atraer electrones hacia sí mismo en un enlace químico. Los elementos de un mismo período tienen electronegatividades similares. La electronegatividad aumenta de izquierda a derecha en un período, lo que significa que los elementos del extremo derecho del período son más electronegativos que los del extremo izquierdo.
6. Energía de ionización
La energía de ionización es la cantidad de energía necesaria para eliminar un electrón de un átomo. Los elementos de un mismo período tienen energías de ionización similares. A medida que se mueve de izquierda a derecha en un período, la energía de ionización aumenta debido a una mayor atracción del núcleo sobre los electrones de valencia.
Comparación con tablas
Para tener una mejor comprensión de las similitudes y diferencias entre los elementos de un mismo período, se pueden usar tablas. Las tablas son una herramienta útil para organizar y presentar información de manera clara y concisa. En una tabla periódica HTML, los elementos se organizan en filas horizontales (periodos) y columnas verticales (grupos) para mostrar sus propiedades químicas.
listas
Las listas también pueden ser útiles para mostrar las similitudes y diferencias entre los elementos de un mismo período. Una lista ordenada puede ser útil para mostrar los elementos en orden de número atómico, mientras que una lista no ordenada puede ser útil para mostrar propiedades químicas como la electronegatividad y la energía de ionización.
Conclusión
En resumen, Los elementos de un mismo período tienen varias similitudes notables que los unen. Tienen el mismo número de capas electrónicas y la misma cantidad de orbitales, lo que significa que tienen propiedades químicas similares. También tienen tamaños atómicos, electronegatividades y energías de ionización similares. Estas similitudes son importantes para entender cómo los elementos interactúan y forman compuestos químicos.
Preguntas frecuentes
1. ¿Por qué los elementos de un mismo período tienen propiedades químicas similares?
Los elementos de un mismo período tienen propiedades químicas similares porque tienen el mismo número de capas electrónicas y la misma cantidad de orbitales. Esto significa que interactúan de manera similar con otros átomos, lo que lleva a la formación de compuestos químicos con elementos similares.
2. ¿Por qué disminuye el tamaño atómico a medida que se mueve de izquierda a derecha en un período?
El tamaño atómico disminuye a medida que se mueve de izquierda a derecha en un período debido a una mayor atracción del núcleo sobre los electrones de valencia. A medida que se agregan protones al núcleo, la carga nuclear efectiva aumenta, lo que hace que los electrones de valencia se atraigan más hacia el núcleo.
3. ¿Por qué aumenta la electronegatividad a medida que se mueve de izquierda a derecha en un período?
La electronegatividad aumenta a medida que se mueve de izquierda a derecha en un período debido a una mayor atracción del núcleo sobre los electrones de valencia. Los elementos del extremo derecho del período tienen núcleos con una carga nuclear efectiva más alta, lo que hace que atraigan más fuertemente los electrones de valencia.
4. ¿Por qué aumenta la energía de ionización a medida que se mueve de izquierda a derecha en un período?
La energía de ionización aumenta a medida que se mueve de izquierda a derecha en un período debido a una mayor atracción del núcleo sobre los electrones de valencia. Los elementos del extremo derecho del período tienen núcleos con una carga nuclear efectiva más alta, lo que hace que sea más difícil eliminar un electrón de valencia.
5. ¿Qué es una tabla periódica HTML?
Una tabla periódica HTML es una versión de la tabla periódica que se presenta en formato HTML (lenguaje de marcado de hipertexto). En una tabla periódica HTML, los elementos se organizan en filas horizontales (periodos) y columnas verticales (grupos) para mostrar sus propiedades químicas.

Deja una respuesta